はじめに
アデノ随伴ウイルス(AAV)は、現代医学において最も有望で広く利用されているツールの一つとして、その地位を確立しています。米国食品医薬品局(FDA)によって承認された複数の「根治的」治療法の基盤技術であり、基礎神経科学研究に革命をもたらしました [1, 2, 3]。しかし、AAVの計り知れない可能性を最大限に引き出すためには、その生物学的特性、製造や免疫原性といった課題、そして倫理的かつ安全な使用を保証するための堅牢な枠組みについて、深い理解が不可欠です [3, 4, 5]。
本稿では、最新の国際的な文献に基づき、専門家レベルの包括的な解説を提供します。AAVの基本生物学から、ベクターとしての設計、遺伝子治療や研究における多様な応用、さらには実践、安全性、倫理に関する重要な考察までを網羅します。本稿が、研究者、学生、そして臨床医の方々にとって、この複雑で急速に進化する分野を航海するための羅針盤となることを目的とします。

Part 1: AAVベクターの基礎
このセクションでは、AAVとは何か、どのようにして治療ツールとして設計されるのか、そして細胞レベルでどのように機能するのかという基本的な知識を確立します。
1.1. アデノ随伴ウイルス(AAV)とは?「無害な」混入物から脚光を浴びるまで
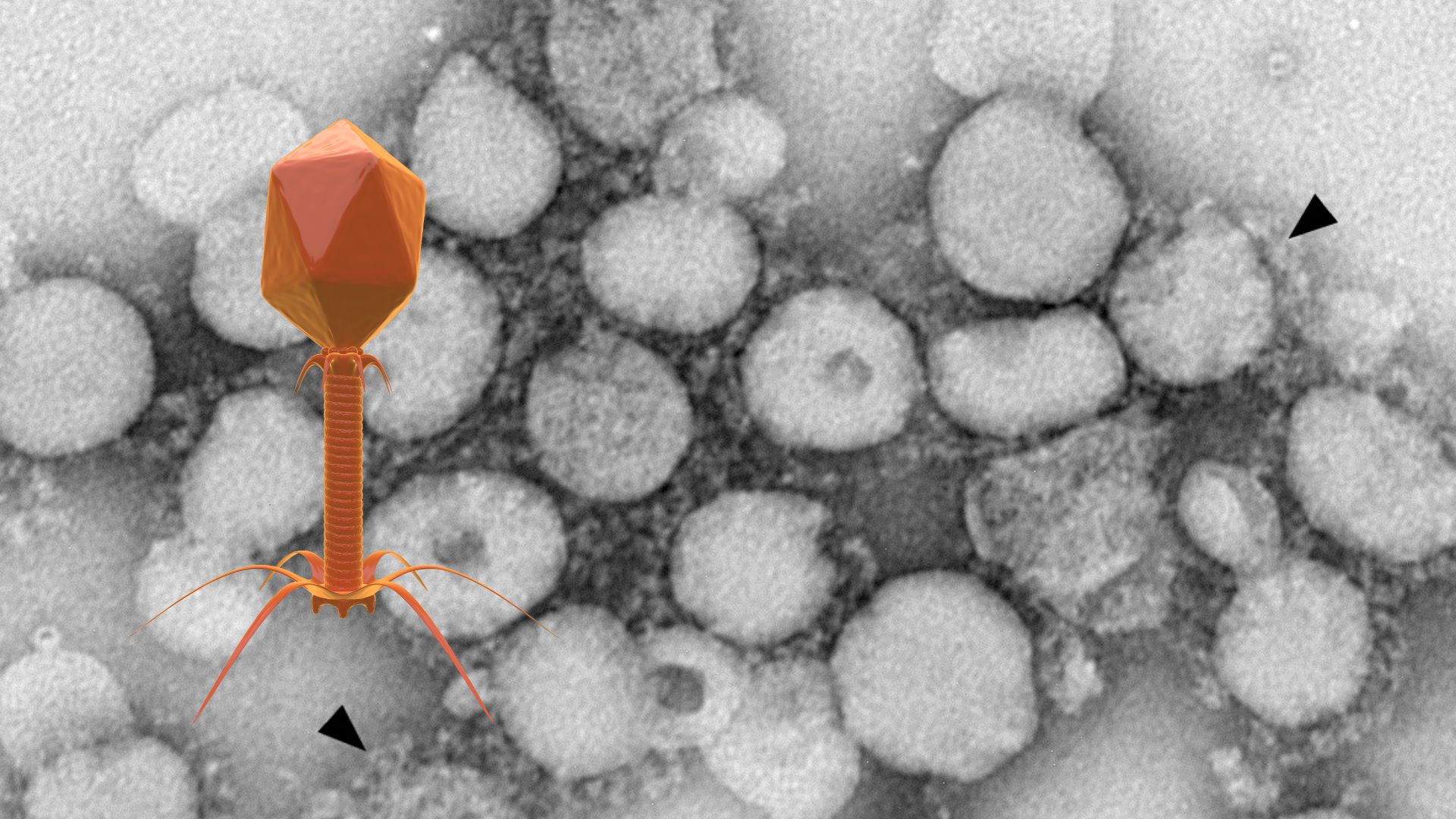
AAVは、1960年代にアデノウイルスの調製物中から「混入物」として発見されました [1, 2, 6, 7, 8]。パルボウイルス科のDependoparvovirus属に分類されるこのウイルスは、その後の研究で驚くべき特性が次々と明らかにされました [1, 4, 8]。
主な生物学的特性
- 非病原性: 野生型AAVは、ヒトに対して既知の疾患を引き起こさないことが最大の特徴です [3, 4, 9, 10, 11]。実際、ヒト集団の大部分は無症状のままAAVに対する抗体を保有(血清陽性)しており、その安全性は他の多くのウイルスベクターと比較して際立っています [8, 9, 12]。
- ヘルパーウイルス依存性: AAVは自己複製能力を持たず、その増殖にはアデノウイルスやヘルペスウイルスといった「ヘルパーウイルス」の共感染が必要です [2, 4, 8, 13, 14]。この性質は、体内で無制御に増殖しないという、極めて重要な天然の安全機構となっています。
構造とゲノム
AAVは、直径約25 nmの小さな非エンベロープ型正二十面体カプシド構造を持ちます [1, 6, 13, 15]。このカプシドは、VP1、VP2、VP3という3種類のウイルスタンパク質が特定の比率で組み合わさって形成されます [1, 15]。内部には、約4.7キロベース(kb)の小さな一本鎖DNA(ssDNA)ゲノムが格納されています [1, 13]。野生型ゲノムは、ウイルスの複製を担うrep遺伝子とカプシドをコードするcap遺伝子から構成され、両端は逆方向末端反復配列(Inverted Terminal Repeats, ITRs)と呼ばれる特徴的な配列で挟まれています [1, 15, 16, 17]。このITRは、ゲノムの複製とカプシドへのパッケージングに必須の役割を果たします [1]。
AAVの成功の背景には、一つのパラドックスが存在します。当初、ウイルス研究は病気を引き起こす病原体に焦点が当てられていたため、病原性を持たないAAVは科学的に「興味深い」対象とは見なされず、単なる研究室の「混入物」として長年注目されませんでした [1, 8, 10]。しかし、アデノウイルスやレトロウイルスを用いた初期の遺伝子治療が、強い免疫応答やがん化(挿入変異)といった深刻な安全性問題に直面したことで、状況は一変します [15, 18, 19]。より安全な遺伝子導入の「運び屋(ベクター)」が求められるようになり、研究者たちはAAVを再評価しました。その結果、かつて「弱点」と見なされていた非病原性や複製欠損といった性質が、実は治療応用における最大の「強み」であることが明らかになったのです。非病原性は低い免疫原性と高い安全性に直結し [9, 20, 21]、複製欠損は体内での意図しない増殖を防ぐ重要な安全機構となります [22, 23]。このように、AAVが研究室の片隅から臨床の最前線へと躍進した歴史は、生物学的実体の価値が文脈によっていかに再定義されるかを示す、科学的発見における重要な教訓と言えるでしょう。
1.2. 遺伝子導入の「運び屋」を設計する:組換えAAV(rAAV)ベクター
治療応用のため、研究者たちは野生型AAVを遺伝子操作し、組換えAAV(rAAV)ベクターを開発しました。その設計思想は、ウイルスの「殻」だけを利用し、中身を治療用の遺伝子に入れ替えるというものです。
rAAVの基本構成
- ウイルスの「骨格」を空にする: rAAVの設計における核心は、ウイルスの増殖に必須なrep遺伝子とcap遺伝子を完全に取り除き、そのスペースに治療用の遺伝子発現カセットを挿入することです [1, 4, 22, 24]。
- 必須コンポーネント:
- 逆方向末端反復配列(ITRs): rAAVベクターに残される唯一のウイルス由来配列です。通常は最も研究が進んでいるAAV2血清型由来のITRが用いられ、ゲノムの複製、カプシドへのパッケージング、そして標的細胞の核内での安定なエピソーム形成に不可欠です [1, 4, 17, 25]。
- 発現カセット: 治療効果を発揮するための設計図であり、①遺伝子発現を駆動するプロモーター(CMVやCAGのような構成的プロモーター、あるいは特定の組織でのみ働く組織特異的プロモーター)、②目的の治療遺伝子(Gene of Interest, GOI)、③mRNAを安定化させるポリアデニル化(polyA)シグナルから構成されます [1, 25]。
ゲノムの維持と安全性
rAAVベクターは、標的細胞(特に分裂しない細胞)の核内に到達すると、宿主の染色体には組み込まれず、染色体外で安定した環状のエピソームとして長期間存在します [1, 9, 20]。宿主ゲノムへの組み込みがほとんど起こらないこの性質は、初期のレトロウイルスベクターで見られたような、ゲノムを傷つけてがんを引き起こすリスク(挿入変異誘発)を劇的に低減させる、極めて重要な安全上の利点です [1, 15, 20]。
設計上の限界とそれを克服する工夫
- 搭載容量の制限: AAVベクターの大きな課題の一つが、搭載できる遺伝子のサイズです。ITRを含めて約5 kb未満という制限があり、デュシェンヌ型筋ジストロフィーの原因遺伝子であるジストロフィン全長のような巨大な遺伝子を運ぶことはできません [1, 6, 25, 26, 27]。
- 自己相補型AAV(scAAV): 通常のrAAV(ssAAV)では、核内で一本鎖DNAから二本鎖DNAへの変換が必要となり、これが遺伝子発現の律速段階となります [1, 20, 22, 25]。この問題を解決するために開発されたのが自己相補型AAV(scAAV)です [1, 22, 25]。片方のITRを改変することで、ゲノムDNAが自己で折りたたまれて二本鎖構造を形成するように設計されています。これにより、二本鎖への変換ステップを省略し、より迅速かつ強力な遺伝子発現が可能になります。ただし、その代償として搭載できる遺伝子のサイズは半分(約2.2〜2.5 kb)になります [1, 22, 25, 26]。
1.3. 多様な組織を標的とする:血清型と指向性
AAVベクターが特定の組織や細胞に遺伝子を届ける能力、すなわち**組織指向性(トロピズム)**は、ベクターの表面を覆うカプシドタンパク質によって決まります。カプシドが細胞表面の特定の受容体と結合することで、感染が成立します [12, 15, 20, 28]。
自然界にはAAV1からAAV13までの主要な血清型(セロタイプ)に加え、数百もの亜種が存在します [1, 8, 16, 29]。研究者たちは、これらの天然の多様性を利用するだけでなく、異なる血清型のゲノム(ITR)とカプシドを組み合わせたシュードタイプベクター(例:AAV2/8はAAV2のITRとAAV8のカプシドを持つ)や、複数の血清型の特性を併せ持つよう遺伝子操作されたハイブリッドカプシド(例:AAV-DJ)を創出することで、指向性や導入効率をさらに精密に制御しています [13, 17, 22]。
研究者がin vivo実験を計画する際、どの血清型を選択するかは実験の成否を左右する根源的な決定です。以下の表は、主要なAAV血清型の特性と主な標的組織をまとめたものであり、研究者にとって貴重な参照ガイドとなります。
表1:主要AAV血清型の特性と組織指向性
| 血清型 | 主な標的組織・細胞 (in vivo) | 主な特徴・備考 |
| AAV1 | 骨格筋、心筋、中枢神経系(CNS) | 最初の承認遺伝子治療薬(Glybera)で使用 [12, 29]。筋肉への導入効率が高い。 |
| AAV2 | CNS、肝臓、筋肉 | 最も研究されているが、ヒトでの既存抗体保有率が高い [12, 29]。 |
| AAV4 | CNS、網膜色素上皮(RPE) | [26, 30] |
| AAV5 | 眼(網膜)、肺、アストロサイト | 遺伝的に他の血清型と最も異なる [12, 29]。網膜への導入効率が高い。 |
| AAV6 | 肺、心臓、筋肉 | [26, 29] |
| AAV8 | 肝臓(非常に高効率)、筋肉、網膜 | 発現開始が速く、肝臓を標的とする治療で多用される [29, 31]。 |
| AAV9 | 心臓、CNS(血液脳関門を通過)、肝臓、筋肉 | 全身投与で脳に到達可能 [27, 29]。SMA治療薬Zolgensmaで使用。 |
| AAVrh10 | CNS、心臓、肝臓、骨格筋 | [26, 31] |
| PHP.B/eB | CNS(マウスで血液脳関門通過能を強化) | CNS特異的な応用を目指して人工的に設計された [26, 29]。 |
| AAV-retro | 神経回路の逆行性輸送 | 神経回路の入力マッピングに特化して設計された [29, 32]。 |
出典: [12, 16, 26, 27, 29, 30, 31, 32, 33, 34, 35, 36]
1.4. 細胞内への旅:AAVはどのようにして積み荷を届けるのか
AAVベクターによる遺伝子導入は、複数の障壁を乗り越える複雑な旅路です [6, 15]。
- 細胞表面への結合: AAVはまず、細胞表面にある一次受容体(AAV2の場合はヘパラン硫酸プロテオグリカンなど)や共受容体に結合します [15, 37]。特に、ほとんどの血清型に共通する**AAV受容体(AAVR/KIAA0319L)**の発見は、細胞への侵入を司る重要な「門番」を特定した画期的な成果でした [37, 38]。
- 細胞内への取り込み(エンドサイトーシス): 結合後、ウイルスはクラスリン介在性エンドサイトーシスなどの様々な経路を通じて細胞内に取り込まれます [15, 37]。この経路は血清型や細胞種によって異なります。
- 細胞内輸送とエンドソームからの脱出: 細胞内に取り込まれたAAVは、エンドソームと呼ばれる小胞に包まれ、核へと輸送されます。この過程でエンドソーム内が酸性化すると、カプシドの構造が変化し、VP1タンパク質の一部(VP1u)が外部に露出します。このVP1uにはホスホリパーゼA2(PLA2)ドメインが含まれており、これがエンドソーム膜を破壊してウイルスが細胞質へ脱出するのを助けます [15, 37]。多くの血清型では、ゴルジ体への輸送も重要なステップです [37]。
- 核への侵入と脱殻: 細胞質に脱出したカプシドは、核膜孔を通って核内へと侵入します [1, 15]。核内でカプシドが分解(脱殻)され、内部の一本鎖DNAゲノムが放出されます。
- ゲノムの変換と発現: 放出された一本鎖DNAは、宿主細胞が持つDNAポリメラーゼによって、遺伝子発現が可能な二本鎖DNAへと変換されます。このステップは遺伝子発現の律速段階として知られており、scAAVはこのステップを省略することで効率を高めています [1, 20, 22, 25]。最終的に、この二本鎖エピソームが鋳型となり、治療用タンパク質が産生されます。
Part 2: AAVベクターの多様な応用
このセクションでは、AAVが医学と基礎研究の両分野でいかに大きな影響を与えているかを示します。
2.1. 遺伝子治療:根治医療の夢を実現する
AAVベクターは、その優れた安全性と持続的な遺伝子発現能力により、遺伝子治療の主役となっています。
治療戦略
- 遺伝子補充療法: 最も一般的な戦略で、機能不全に陥った遺伝子の正常なコピーを補充することで、劣性遺伝形式の単一遺伝子疾患を治療します [1, 4]。代表例として、脊髄性筋萎縮症(SMA)に対するZolgensmaや、遺伝性網膜ジストロフィーに対するLuxturnaが挙げられます [4, 39, 40]。
- 遺伝子サイレンシング(抑制): AAVを用いてshRNA(short hairpin RNA)などのRNA干渉ツールを送達し、毒性を持つ異常なタンパク質を産生する遺伝子の発現を抑制します。ハンチントン病などがこのアプローチの対象です [1, 31]。
- 遺伝子追加療法: 欠損遺伝子を置き換えるのではなく、新たな治療効果を持つ遺伝子を追加導入する戦略です。例えば、抗HIV抗体を産生する遺伝子を導入する研究が進められています [1, 4]。
- 遺伝子編集: AAVを運び屋として、CRISPR-Cas9のようなゲノム編集ツールを体内に送り込み、宿主ゲノム上の変異を恒久的に修復する最先端のアプローチです [4, 41]。
画期的な承認済み治療薬
AAVを用いた遺伝子治療は、もはや理論上の存在ではありません。実際に複数の治療薬がFDAや欧州医薬品庁(EMA)の承認を受け、患者に届けられています。
- Luxturna®(voretigene neparvovec): AAV2を用いた、希少遺伝性網膜ジストロフィーの治療薬。眼という免疫応答が起きにくい(免疫寛容)部位でのAAVの有効性を証明した画期的な承認例です [4, 39, 40]。
- Zolgensma®(onasemnogene abeparvovec): AAV9を用いたSMAの治療薬。全身投与によって血液脳関門を突破し、標的である運動ニューロンに遺伝子を届ける能力を示しました [27, 39, 40]。
- Hemgenix®(etranacogene dezaparvovec) と Roctavian®(valoctocogene roxaparvovec): それぞれAAV5を用いた血友病Bおよび血友病Aの治療薬。肝臓を標的として凝固因子を産生させる治療法です [12, 39, 40, 42]。
- Elevidys®(delandistrogene moxeparvovec): デュシェンヌ型筋ジストロフィーの治療薬。AAVの搭載容量の制限から、機能的な「マイクロジストロフィン」遺伝子を送達する点が特徴です [39, 40, 42]。
現在、225件を超える臨床試験が進行中であり [1, 8, 16]、パーキンソン病やハンチントン病といった神経変性疾患 [13, 27]、代謝性疾患、心血管疾患など、対象は多岐にわたります。これらの試験では、AAV8やAAV9といった血清型が広く活用されています [4, 43, 44, 45]。
表2:FDA/EMAに承認された主要なAAV遺伝子治療薬
| 販売名 | 一般名 | 対象疾患 | AAV血清型 | 投与経路 | 承認機関 |
| Luxturna® | voretigene neparvovec-rzyl | 遺伝性網膜ジストロフィー(RPE65変異) | AAV2 | 網膜下注射 | FDA, EMA |
| Zolgensma® | onasemnogene abeparvovec-xioi | 脊髄性筋萎縮症(SMA) | AAV9 | 静脈内投与 | FDA, EMA |
| Hemgenix® | etranacogene dezaparvovec-drlb | 血友病B | AAV5 | 静脈内投与 | FDA, EMA |
| Roctavian® | valoctocogene roxaparvovec-rvox | 重症血友病A | AAV5 | 静脈内投与 | FDA, EMA |
| Elevidys® | delandistrogene moxeparvovec-rokl | デュシェンヌ型筋ジストロフィー | AAVrh74 | 静脈内投与 | FDA |
| Beqvez® | fidanacogene elaparvovec-dzkt | 血友病B | AAVrh74var | 静脈内投与 | FDA, EMA |
出典: [4, 12, 39, 40, 42, 46, 47]
2.2. 神経科学研究のツールキット
AAVは、分裂しないニューロンに効率よく感染し、長期的な発現を低毒性で実現できるため、神経科学研究において不可欠なツールとなっています [22, 25, 35, 48]。
- 神経回路マッピング: 定位脳手術を用いて特定の脳領域にAAVを注入し、緑色蛍光タンパク質(GFP)などの蛍光レポーターを発現させます。これにより、ニューロンの形態を可視化し、軸索投射を追跡して脳の「配線図」を解明することができます [35, 36, 49, 50, 51]。特に、神経回路の入力を調べるためには、逆行性に輸送されるAAV-retroが強力なツールとなっています [29, 32]。
- オプトジェネティクス(光遺伝学): AAVを用いて、特定のニューロンに光感受性イオンチャネル(チャネルロドプシンなど)の遺伝子を導入します。これにより、光を照射することでミリ秒単位の精度で神経活動を活性化または抑制することが可能になり、神経回路と行動の因果関係を直接的に検証できます [22, 48, 49, 52, 53, 54]。
- ケモジェネティクス(化学遺伝学): AAVを用いて「デザイナー薬物によってのみ活性化されるデザイナー受容体(DREADDs)」を発現させます [22, 55, 56, 57, 58, 59, 60]。この人工受容体は、通常は不活性な特定の薬剤(CNOやDCZなど)を投与することによってのみ作動し、より長い時間スケールで神経活動を非侵襲的かつ可逆的に操作することができます [56, 57, 60]。
2.3. ゲノム編集の次なるフロンティア:CRISPR-Cas9のin vivoデリバリー
CRISPR-Cas9コンポーネントを体内に直接送達することは大きな挑戦ですが、AAVはそのための主要なベクター候補と目されています。ただし、その小さな搭載容量が大きな障壁となっています [31, 41, 61]。研究者たちは、より小さなCas9(例:S. aureus由来)を使用したり [31]、Cas9とガイドRNAを別々のAAVベクターで運ぶデュアルベクター戦略を用いたりして [25]、この課題に取り組んでいます。しかし近年、AAVベクターゲノムがCRISPRの標的部位に複数連結して挿入されるという、検出が困難な意図しないゲノム変化が頻繁に起こることが報告されており、新たな安全性の懸念として注目されています [62, 63]。
これらの応用例は、AAVが単なる遺伝子補充のツールではなく、他の革新的な技術と融合することでその力を増幅させるプラットフォーム技術へと進化したことを示しています。当初、AAVは単純な遺伝子の「運び屋」でした [1]。しかし、オプトジェネティクスやケモジェネティクスが開発されると、これらのツールをin vivoで特定のニューロンに導入する手段が必要となり、神経指向性と安全性を兼ね備えたAAVがその完璧なパートナーとなりました [48, 49, 56]。同様に、CRISPRの治療応用もin vivoデリバリーという壁に直面しており、AAVがその解決策として期待されています [41, 61, 64]。この技術の融合は、AAVがもはや単独のツールではなく、最先端の生命操作技術群を支える中心的なデリバリープラットフォームであることを意味します。AAVの未来は、これらの他分野の未来と密接に結びついており、例えばAAVカプシド工学の進歩が、in vivo CRISPR治療のブレークスルーに直結する可能性があるのです。この相互連携こそが、現代の生物医学におけるイノベーションの強力な駆動力となっています。

Part 3: 研究者のための実践的課題と解決策
このセクションでは、AAVの製造から効果的な使用法まで、研究現場で直面する現実的な課題について解説します。
3.1. AAVベクターの製造と精製
製造方法
- トリプル・トランジェント・トランスフェクション法: 研究室レベルで最も一般的な製造法です。HEK293のような培養細胞に、3種類のプラスミド(①ITRとGOIを含むAAVトランスファープラスミド、②rep/cap遺伝子を持つパッケージングプラスミド、③アデノウイルス由来のヘルパー遺伝子を持つヘルパープラスミド)を同時に導入(トランスフェクション)してウイルス粒子を産生させます [17, 26, 65, 66]。
- その他の製造システム: 産業スケールでの大量生産には、バキュロウイルス(昆虫細胞Sf9を使用)やヘルペスウイルスを用いた、より拡張性の高いシステムや、必要な遺伝子をすべて組み込んだ安定的な生産細胞株の開発が進められています [17, 65, 67, 68]。
精製の課題と方法
精製は、宿主細胞由来のタンパク質やDNAといった不純物を除去するために不可欠です。特に重要なのが、治療用ゲノムを持たない**空のカプシド(empty capsid)**の除去です。空のカプシドは治療効果がないにもかかわらず免疫応答を引き起こすため、その存在はベクターの品質を大きく左右します [69, 70]。
- 超遠心分離法: 古くからの標準的な精製法です。塩化セシウム(CsCl)やヨージキサノールを用いた密度勾配遠心により、粒子を密度に応じて分離します。ヨージキサノールは毒性が低く穏やかな条件ですが、一部の血清型では効率が劣る場合があります。この方法は効果的ですが、手間がかかり、大量生産には向きません [65, 71, 72, 73, 74]。
- クロマトグラフィー法: 近代的な大量生産に適した代替法です。イオン交換(AEX)やアフィニティークロマトグラフィーなどがあり、拡張性に優れていますが、血清型ごとに最適な条件設定が必要です [71, 72, 73, 74]。
力価(タイター)測定
力価とは、ウイルス溶液中のゲノム含有粒子濃度(vg/mL)を指し、品質管理において極めて重要な指標です。
- qPCR(定量的PCR): 従来法であり、既知濃度の標準DNA(標準曲線)と比較してゲノム量を定量します。しかし、測定ごとにばらつきが生じやすく、精度に課題がありました [75, 76, 77]。
- ddPCR(ドロップレット・デジタルPCR): 新たな標準となりつつある方法です。PCR反応液を微小なドロップレットに分割することで、標準曲線なしにゲノムの絶対数をカウントできます。高価で処理能力は低いものの、非常に高い精度と再現性を誇ります [75, 76, 77, 78, 79]。
製造上のボトルネック
AAVの製造は非常に複雑かつ高コストであり、この分野全体の大きなボトルネックとなっています。同規模のバイオリアクターで製造した場合、AAVの収量はモノクローナル抗体医薬の数桁も低いのが現状です [4, 68, 69, 80, 81]。特に、治療効果のある粒子(Full capsid)と空のカプシド(Empty capsid)の比率は重要な品質指標であり、空のカプシドの割合を減らし、効率的に除去する技術の開発が急務です [69, 70, 82]。
3.2. 免疫という障壁とその克服法
AAVベクターに対する宿主の免疫応答は、臨床応用における最大の障壁の一つです。
宿主の免疫応答
- 自然免疫: AAVは、Toll様受容体(TLR2, TLR9)を介して一過性の軽度な自然免疫応答を誘導し、サイトカイン産生を引き起こすことがあります [9, 24]。
- 液性免疫(抗体): これが最大の課題です。自然感染により、多くの人々(AAV2では最大80%)がAAVに対する**中和抗体(NAbs)**を既に保有しています [4, 8, 9, 83]。この中和抗体はベクターに結合してその感染を阻害するため、治療効果を完全に失わせてしまいます。そのため、多くの場合、高い中和抗体価を持つ患者は臨床試験の対象から除外されます [43, 44]。
- 細胞性免疫(T細胞): 遺伝子導入された細胞の表面にAAVカプシドの断片が提示されると、細胞傷害性T細胞がこれを異物と認識して攻撃し、治療効果を持つ細胞を排除してしまうことがあります [4, 9, 24, 84]。これにより、時間とともに治療効果が失われたり、2回目以降の投与(再投与)が困難になったりします。
免疫回避のための戦略
- 患者のスクリーニング: 最も単純なアプローチは、投与前に患者の中和抗体価を測定し、抗体を持たないか、非常に低い患者のみを治療対象とすることです [43, 44, 46]。
- 免疫抑制療法: プレドニゾロンのようなステロイド剤を用いて、ベクター投与中および投与後に一時的に免疫系を抑制する方法です [84, 85]。
- 空のカプシドによる「おとり」作戦: 治療用ベクターと共に大量の空のカプシドを投与します。空のカプシドが「おとり」として中和抗体の大部分を吸収し、治療用ベクターが標的組織に到達するのを助けます [86]。
- カプシド工学: 最も高度なアプローチで、AAVカプシドの表面を改変して抗体から認識されないようにします。合理的な設計や、ウイルスの進化を模倣する指向性進化法に加え、近年では**機械学習(ML)**を用いて、高い生産性、特定の組織指向性、低い免疫原性といった複数の望ましい特性を兼ね備えた「ステルス」カプシドを設計する研究が精力的に進められています [2, 4, 28, 83, 87, 88]。

3.3. 文脈の中のAAV:他のウイルスベクターとの比較
研究者が実験を計画する際、AAVは唯一の選択肢ではありません。レンチウイルスやアデノウイルスといった他の主要なベクターとの特性の違いを理解することは、最適なツールを選択する上で不可欠です。例えば、培養細胞株を恒久的に改変したい場合はゲノムに組み込まれるレンチウイルスが [89, 90]、非常に大きな遺伝子を一時的に発現させたい場合はアデノウイルスが適しています [14, 18]。一方で、分裂しない細胞に安全かつ長期的に遺伝子を導入するin vivo実験では、AAVが理想的な選択肢となります [20, 89]。
表3:主要ウイルスベクターの比較分析
| 特性 | アデノ随伴ウイルス(AAV) | レンチウイルス | アデノウイルス |
| ベクタータイプ | パルボウイルス | レトロウイルス | アデノウイルス |
| ゲノム | 一本鎖DNA | RNA | 二本鎖DNA |
| ゲノムへの影響 | 染色体外(エピソーム)、稀に組み込み | 宿主ゲノムへ組み込み | 染色体外(エピソーム) |
| 搭載容量 | 約4.7 kb | 約9 kb | 最大約36 kb |
| 細胞指向性 | 分裂・非分裂細胞 | 分裂・非分裂細胞 | 分裂・非分裂細胞 |
| 免疫原性 | 非常に低い | 低い | 高い |
| 発現期間 | 長期(非分裂細胞で数年) | 恒久的・安定的 | 一過的(数週間) |
| 主な用途 | In vivo 遺伝子治療・研究 | Ex vivo 遺伝子治療、安定細胞株作製 | ワクチン、がん治療 |
| バイオセーフティ | BSL-1 / BSL-2 | BSL-2 | BSL-2 |
出典: [14, 15, 18, 19, 20, 23, 31, 89, 90, 91, 92]

Part 4: 倫理と安全性:責任ある研究のための枠組み
この最終セクションでは、AAV研究と治療に伴う重要な非科学的側面、すなわち倫理と安全性の問題を取り上げ、責任ある研究活動のための指針を示します。
4.1. 倫理的考察と規制の枠組み
体細胞治療と生殖細胞系列編集の根本的な違い
- 体細胞遺伝子治療: 患者自身の体細胞(生殖細胞以外)を改変する治療法です。遺伝的な変更は次世代に受け継がれません。現在承認されているすべての遺伝子治療はこのカテゴリーに属し、確立された臨床試験の倫理指針に基づいて実施されます [93, 94, 95]。
- 生殖細胞系列ゲノム編集: 精子、卵子、あるいは初期胚のゲノムを改変する行為です。この場合、遺伝的な変更が子孫代々に受け継がれる可能性があり、ヒトの遺伝的遺産を恒久的に変えうるため、非常に大きな倫理的議論を呼んでいます。多くの国で法的に禁止または厳しく制限されています [5, 93, 95]。
主要な倫理的論点
- インフォームド・コンセント: 医療倫理の根幹です。生殖細胞系列編集では、まだ生まれていない将来世代から同意を得ることは不可能であり、これが大きな倫理的課題となります [61, 95]。
- 安全性と予期せぬ影響: 標的以外の遺伝子を誤って改変してしまう「オフターゲット効果」や、長期的な健康への影響、ヒト遺伝子プールへの意図しない変化など、未知のリスクに対する懸念が根強くあります [94, 95, 96, 97]。初期のアデノウイルスベクターの臨床試験で被験者が死亡したジェシー・ゲルシンガー氏の事例は、安全性を最優先するべきであるという強力な教訓として語り継がれています [5]。
- 公平性とアクセス: Zolgensmaの価格が2億円を超えるように、遺伝子治療は極めて高額です [64]。これにより、治療を受けられるのが富裕層に限られ、社会的な不平等をさらに拡大させるのではないかという、社会正義に関する深刻な問題が提起されています [94, 96, 98]。
- 治療とエンハンスメント(能力増強)の境界線: 現在の研究は重篤な疾患の治療に焦点が当てられていますが、将来的には知能や外見といった非医療的な能力向上に技術が応用される可能性があります。どこに倫理的な一線を引くべきか、社会的な合意は形成されていません [61, 94, 98]。
これらの複雑な問題に対し、世界保健機関(WHO)や米国科学アカデミー(NAS/NAM)などの国際機関が主導し、ガイドラインの策定や透明性の確保、責任ある研究の推進に向けた議論が進められています [93, 94, 95]。
4.2. バイオセーフティレベル(BSL)と実験室での取り扱い
rAAVの分類
米国国立衛生研究所(NIH)のガイドラインによれば、rAAVベクターは以下の基準に基づいて取り扱いのレベルが定められています。
- バイオセーフティレベル1(BSL-1): rAAVベクターが、①搭載する遺伝子(トランスジーン)が毒素やがん遺伝子をコードしない、かつ②ヘルパーウイルスなしで製造されている、という特定の基準を満たす場合、**リスクグループ1(RG1)**と見なされ、BSL-1施設での取り扱いが可能です [23, 99, 100, 101]。
- バイオセーフティレベル2(BSL-2): 上記の基準を満たさない場合、あるいは、HEK293細胞のようなヒト由来細胞株で製造された場合は、BSL-2での取り扱いが義務付けられます。これは、ウイルス自体のリスクとは別に、ヒト由来の物質を扱う際の米国労働安全衛生庁(OSHA)の血液由来病原体基準が適用されるためです [99, 102, 103]。
表4:rAAVのバイオセーフティレベルと取り扱い要件の概要
| 要件 | BSL-1 / ABSL-1 | BSL-2 / ABSL-2 |
| 分類基準 | ・危険性のない遺伝子を搭載・ヘルパーウイルス不使用・非ヒト細胞(昆虫細胞等)で製造、または純度が証明されている | ・がん遺伝子や毒素を搭載・ヘルパーウイルス使用・ヒト細胞(HEK293等)で製造 |
| 実験室での実践 | 標準的な実験室操作、手洗い、アクセス制限 | BSL-1の要件に加え、バイオハザード表示、厳格なアクセス制限 |
| 個人防護具(PPE) | 実験着、手袋、保護メガネを推奨 | 実験着、手袋、保護メガネが必須 |
| 必須設備 | オープンベンチでの操作が許容される場合がある(各施設のIBC判断による) | エアロゾル発生の恐れがある操作は全てクラスII安全キャビネット内で実施。密閉式遠心ローターを使用。 |
| 廃棄物処理 | 10%次亜塩素酸ナトリウム溶液(漂白剤)、オートクレーブ | 10%次亜塩素酸ナトリウム溶液、オートクレーブ。各施設のバイオハザード廃棄物手順に従う。 |
出典: [23, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109]
4.3. 動物実験における倫理的配慮(IACUC)
全ての動物実験は、動物の福祉を確保するために、各研究機関の**動物実験委員会(IACUC)**による審査と承認を受けなければなりません [110, 111]。
動物福祉に関する主要な考慮事項
- 科学的正当性とベクターの品質: 研究者はAAVの使用目的を科学的に正当化し、使用するベクターが無菌で発熱物質を含まないことを保証する必要があります。特に、医薬品グレードでない薬剤の使用には、IACUCの特別な承認が必要です [110]。
- 投与経路: 選択される投与経路は、動物への苦痛を最小限に抑えるものでなければなりません。神経科学研究で多用される定位脳手術による脳内注入は、麻酔、鎮痛、無菌操作が必須です [110]。
- 苦痛の評価と緩和: 研究者は、処置後に動物が示す痛みや苦痛の兆候を注意深く観察し、適切な鎮痛処置を施す義務があります [111]。
- 人道的なエンドポイント: 動物の苦痛を長引かせないために、どのような状態になったら実験を終了し、安楽死処置を行うかという明確な基準(人道的なエンドポイント)を事前に設定することが、すべての動物実験計画において不可欠です [111]。
結論と今後の展望
AAVは、生物学的な偶然の発見から、遺伝子治療と神経科学の基盤技術へと目覚ましい発展を遂げました。その高い安全性と汎用性は、かつて治療不可能とされた疾患に希望の光を灯しています [1, 25, 35]。しかし、そのポテンシャルを最大限に発揮するためには、依然として重要な課題が残されています。
残された課題
- 免疫原性: 既存の中和抗体やT細胞応答を回避し、より多くの患者を治療対象とし、再投与を可能にするための戦略が不可欠です [83, 84, 85, 112]。
- 製造とコスト: 収量を向上させ、空のカプシドの割合を減らし、治療薬をより安価で利用しやすくするための、効率的で拡張性のある製造プロセスの確立が急務です [68, 69, 81]。
- 標的指向性とデリバリー: 標的組織への送達特異性を高め、オフターゲット効果を最小限に抑える技術の向上が求められます [2, 28]。
未来への展望
- AI駆動型の設計: 機械学習やAIを活用し、組織指向性、生産性、免疫回避性といった複数の特性を最適化した次世代カプシドを合理的に設計するアプローチが、今後の大きな潮流となるでしょう [88]。
- 治療対象の拡大: 希少な単一遺伝子疾患だけでなく、より一般的な多因子疾患へと治療の範囲を広げていくことが期待されます [4, 13]。
- 技術の融合: AAVとCRISPR、オプトジェネティクスといった他の革新的ツールとの融合は、今後も新たな研究手法や治療法を生み出す原動力となります [41, 49]。
AAVが秘める変革の可能性は計り知れません。その未来は、分子生物学、免疫学、工学といった多分野にわたる協力と、倫理的かつ安全な実践への揺るぎないコミットメントにかかっています。
引用文献
- Adeno-Associated Virus Vectors: Principles, Practices, and … – MDPI, 7月 13, 2025にアクセス、 https://www.mdpi.com/1999-4915/17/2/239
- Natural Adeno-Associated Virus Serotypes and Engineered Adeno-Associated Virus Capsid Variants: Tropism Differences and Mechanistic Insights – MDPI, 7月 13, 2025にアクセス、 https://www.mdpi.com/1999-4915/16/3/442
- Adeno-associated virus vector as a platform for gene therapy delivery – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6927556/
- Nature Review: The Past and Present of AAV Gene Therapy Vectors, 7月 13, 2025にアクセス、 https://www.ebraincase.com/support/literature-interpretation/2662.html
- Gene therapy: Regulations, ethics and its practicalities in liver disease – PubMed Central, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2705082/
- Cellular transduction mechanisms of adeno-associated viral vectors – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC5138113/
- Adeno-associated virus biology – PubMed, 7月 13, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/22034024/
- The Interplay between Adeno-Associated Virus and Its Helper Viruses – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC7354565/
- Adeno-associated virus – Wikipedia, 7月 13, 2025にアクセス、 https://en.wikipedia.org/wiki/Adeno-associated_virus
- Gene Therapy Using Adeno-Associated Virus Vectors – PMC – PubMed Central, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2570152/
- Adeno-associated virus vectors for gene therapy – PubMed, 7月 13, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/7584109/
- Various AAV Serotypes and Their Applications in Gene Therapy: An Overview – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC10000783/
- Biology of adeno-associated viral vectors in the central nervous system – Frontiers, 7月 13, 2025にアクセス、 https://www.frontiersin.org/journals/molecular-neuroscience/articles/10.3389/fnmol.2014.00076/full
- Adenovirus vs AAV – Which Viral Vector Is Right For My Research – BioInnovatise, 7月 13, 2025にアクセス、 https://bioinnovatise.com/articles/adenovirus-vs-aav/
- Adeno-associated virus structural biology as a tool in vector …, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3921901/
- A Comprehensive Atlas of AAV Tropism in the Mouse | bioRxiv, 7月 13, 2025にアクセス、 https://www.biorxiv.org/content/10.1101/2024.09.10.612279v1.full-text
- Adeno-associated virus (AAV) Guide – Addgene, 7月 13, 2025にアクセス、 https://www.addgene.org/guides/aav/
- Viral Vectors Compared: AAV vs. Lentivirus vs. Adenovirus – Patsnap Synapse, 7月 13, 2025にアクセス、 https://synapse.patsnap.com/article/viral-vectors-compared-aav-vs-lentivirus-vs-adenovirus
- A Review of Viral Vectors in Gene Therapy | Biocompare, 7月 13, 2025にアクセス、 https://www.biocompare.com/Editorial-Articles/619487-A-Review-of-Viral-Vectors-in-Gene-Therapy/
- Adeno-Associated Virus (AAV) Gene Expression Vector – VectorBuilder, 7月 13, 2025にアクセス、 https://en.vectorbuilder.com/resources/vector-system/pAAV_Exp.html
- Advantages and drawbacks of AAV vector-mediated gene transfer – Genemedi, 7月 13, 2025にアクセス、 https://www.genemedi.net/i/advantage-drawbacks-aav-vector
- Viral Vectors 101: An Introduction to AAV – Addgene Blog, 7月 13, 2025にアクセス、 https://blog.addgene.org/an-introduction-to-aav
- FAQ: AAV, Adenovirus & More – Vector Biolabs, 7月 13, 2025にアクセス、 https://www.vectorbiolabs.com/resources/faqs/
- Cell-Mediated Immunity to AAV Vectors, Evolving Concepts and Potential Solutions – Frontiers, 7月 13, 2025にアクセス、 https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2014.00350/full
- Adeno-Associated Virus (AAV) as a Vector for Gene Therapy – PMC – PubMed Central, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC5548848/
- Adeno-Associated Virus | Viral Vector Core Facility – Carver College of Medicine, 7月 13, 2025にアクセス、 https://vectorcore.medicine.uiowa.edu/about-our-products/adeno-associated-virus
- Characteristics and advantages of adeno-associated virus vector-mediated gene therapy for neurodegenerative diseases – PubMed Central, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6404499/
- Custom adeno-associated virus capsids: the next generation of recombinant vectors with novel tropism – PubMed, 7月 13, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/15871672/
- Viral Vectors 101: AAV Serotypes and Tissue Tropism – Addgene Blog, 7月 13, 2025にアクセス、 https://blog.addgene.org/aav-serotypes-and-tissue-tropism
- Assessment of Adeno-Associated Virus Serotype Tropism in Human Retinal Explants – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC5909113/
- Lentivirus or AAV For DNA Delivery? | GeneCopoeia™, 7月 13, 2025にアクセス、 https://www.genecopoeia.com/resource/aav-vs-lentivirus-choosing-for-dna-delivery/
- Evaluating the transduction efficiency of systemically delivered AAV vectors in the rat nervous system – Frontiers, 7月 13, 2025にアクセス、 https://www.frontiersin.org/journals/neuroscience/articles/10.3389/fnins.2023.1001007/full
- AAV2 serotype demonstrates the highest transduction efficiency in porcine lung-derived cells – Journal of Animal Reproduction and Biotechnology, 7月 13, 2025にアクセス、 https://www.e-jarb.org/journal/view.html?doi=10.12750/JARB.39.4.254
- Analysis of Transduction Efficiency, Tropism and Axonal Transport of AAV Serotypes 1, 2, 5, 6, 8 and 9 in the Mouse Brain | PLOS One, 7月 13, 2025にアクセス、 https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0076310
- Adeno-Associated Viral Vectors in Neuroscience Research – PMC – PubMed Central, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6931098/
- Comparative Analysis of Six Adeno-Associated Viral Vector Serotypes in Mouse Inferior Colliculus and Cerebellum | eNeuro, 7月 13, 2025にアクセス、 https://www.eneuro.org/content/11/11/ENEURO.0391-24.2024
- Intracellular Trafficking of Adeno-Associated Virus (AAV) Vectors …, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC8413391/
- Mechanism for how common gene therapy vectors enter cells – ScienceDaily, 7月 13, 2025にアクセス、 https://www.sciencedaily.com/releases/2020/01/200123115925.htm
- List of gene therapies – Wikipedia, 7月 13, 2025にアクセス、 https://en.wikipedia.org/wiki/List_of_gene_therapies
- Approved Cellular and Gene Therapy Products – FDA, 7月 13, 2025にアクセス、 https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/approved-cellular-and-gene-therapy-products
- CRISPR-Based Therapeutic Genome Editing: Strategies and In Vivo Delivery by AAV Vectors – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC7236621/
- Available Products – Alliance for Regenerative Medicine, 7月 13, 2025にアクセス、 https://alliancerm.org/available-products/
- Study Details | Gene Therapy for Haemophilia A. – ClinicalTrials.gov, 7月 13, 2025にアクセス、 https://clinicaltrials.gov/study/NCT03001830
- Trial of AAV5-hFIX in Severe or Moderately Severe Hemophilia B | ClinicalTrials.gov, 7月 13, 2025にアクセス、 https://clinicaltrials.gov/study/NCT02396342
- Phase I/II/III Gene Transfer Clinical Trial of scAAV9.U1a.hSGSH | ClinicalTrials.gov, 7月 13, 2025にアクセス、 https://clinicaltrials.gov/study/NCT02716246
- From the Editors: Cell & Gene Therapy Approvals in 2024, 7月 13, 2025にアクセス、 https://www.isctglobal.org/telegrafthub/blogs/ken-ip1/2025/01/16/cell-gene-therapy-approvals-in-2024
- List of U.S. FDA Approved Cell and Gene Therapy Products (43) | BioInformant, 7月 13, 2025にアクセス、 https://bioinformant.com/u-s-fda-approved-cell-and-gene-therapies/
- Optogenetics in the nonhuman primate – Boston University, 7月 13, 2025にアクセス、 https://www.bu.edu/hanlab/files/2010/07/Han-optogenetic-review-Prog-Brain-Res-2012.pdf
- Unlocking the potential of adeno-associated virus in neuroscience: a brief review – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11035420/
- Adeno-Associated Viral Vectors for Mapping, Monitoring, and Manipulating Neural Circuits – PMC – PubMed Central, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3107581/
- Does anybody use AAV-GFP brain injection? – ResearchGate, 7月 13, 2025にアクセス、 https://www.researchgate.net/post/Does-anybody-use-AAV-GFP-brain-injection
- Optogenetics in neuroscience at Nature Methods – Research Communities, 7月 13, 2025にアクセス、 https://communities.springernature.com/posts/optogenetics-in-neuroscience-at-nature-methods
- Analyzing efficacy, stability, and safety of AAV-mediated optogenetic hearing restoration in mice – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC9258265/
- Optogenetics and the future of neuroscience, 7月 13, 2025にアクセス、 https://web.as.uky.edu/Biology/faculty/cooper/ABLE-2021/ABLE-2021-Metabolism%20and%20gene%20expression/Nature%20review-Optogenetics-Aug2015.pdf
- Longitudinal assessment of DREADD expression and efficacy in the monkey brain – eLife, 7月 13, 2025にアクセス、 https://elifesciences.org/reviewed-preprints/105815
- A humanized Gs-coupled DREADD for circuit and behavior modulation – Frontiers, 7月 13, 2025にアクセス、 https://www.frontiersin.org/journals/cellular-neuroscience/articles/10.3389/fncel.2025.1577117/full
- The use of chemogenetics in behavioural neuroscience: receptor variants, targeting approaches and caveats – PubMed Central, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC5843707/
- DREADDs in Epilepsy Research: Network-Based Review – Frontiers, 7月 13, 2025にアクセス、 https://www.frontiersin.org/journals/molecular-neuroscience/articles/10.3389/fnmol.2022.863003/full
- DREADDs for Neuroscientists – PMC – PubMed Central, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC4759656/
- DREADD: A Chemogenetic GPCR Signaling Platform – Oxford Academic, 7月 13, 2025にアクセス、 https://academic.oup.com/ijnp/article/18/1/pyu007/650504
- Bioethical issues in genome editing by CRISPR-Cas9 technology – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC7129066/
- Genome Editing With Cas9 and AAV Generates Frequent Insertion of Viral Vectors That Are Difficult to Detect – CRISPR Medicine News, 7月 13, 2025にアクセス、 https://crisprmedicinenews.com/news/genome-editing-with-cas9-and-aav-generates-frequent-insertion-of-viral-vectors-that-are-difficult-to/
- Genome engineering with Cas9 and AAV repair templates generates frequent concatemeric insertions of viral vectors – ResearchGate, 7月 13, 2025にアクセス、 https://www.researchgate.net/publication/379667404_Genome_engineering_with_Cas9_and_AAV_repair_templates_generates_frequent_concatemeric_insertions_of_viral_vectors
- Highly targeted CRISPR delivery advances gene editing in living animals – Berkeley News, 7月 13, 2025にアクセス、 https://news.berkeley.edu/2024/02/01/highly-targeted-crispr-delivery-advances-gene-editing-in-living-animals/
- Rapid, Simple, and Versatile Manufacturing of Recombinant Adeno-Associated Viral Vectors at Scale – PMC – PubMed Central, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2957274/
- AAV Production by Triple Transfection | BioRender Science Templates, 7月 13, 2025にアクセス、 https://www.biorender.com/template/aav-production-by-triple-transfection
- Development of Stable Packaging and Producer Cell Lines for the Production of AAV Vectors – MDPI, 7月 13, 2025にアクセス、 https://www.mdpi.com/2076-2607/12/2/384/review_report
- Overcoming AAV manufacturing challenges | BioPharma Dive, 7月 13, 2025にアクセス、 https://www.biopharmadive.com/spons/overcoming-aav-manufacturing-challenges/685458/
- Overcoming Challenges in AAV- and rAAV-based Gene Therapies | Biocompare.com, 7月 13, 2025にアクセス、 https://www.biocompare.com/Editorial-Articles/616487-Overcoming-Challenges-in-AAV-and-rAAV-based-Gene-Therapies/
- Challenges Faced by AAV Industrial Production And Coping Strategies (Downstream) – Creative Biogene, 7月 13, 2025にアクセス、 https://www.creative-biogene.com/blog/challenges-faced-by-aav-industrial-production-and-coping-strategies-downstream
- AAV Purification – Methods, Process and Challenges | Danaher Life Sciences, 7月 13, 2025にアクセス、 https://lifesciences.danaher.com/us/en/library/aav-purification.html
- Rapid and simplified purification of recombinant adeno-associated virus – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3374034/
- Comparing ultracentrifugation versus AEX for successful AAV purification – insights.bio, 7月 13, 2025にアクセス、 https://www.insights.bio/cell-and-gene-therapy-insights/webinars/645/Comparing-ultracentrifugation-versus-AEX-for-successful-AAV-purification
- Comprehensive Comparison of AAV Purification Methods: Iodixanol Gradient Centrifugation vs. Immuno-Affinity Chromatography – ResearchGate, 7月 13, 2025にアクセス、 https://www.researchgate.net/publication/376426510_Comprehensive_Comparison_of_AAV_Purification_Methods_Iodixanol_Gradient_Centrifugation_vs_Immuno-Affinity_Chromatography
- A qPCR Method for AAV Genome Titer with ddPCR-Level of Accuracy and Precision – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC7591332/
- Droplet Digital PCR for AAV Quantitation – Addgene Blog, 7月 13, 2025にアクセス、 https://blog.addgene.org/droplet-digital-pcr-for-aav-quantitation
- Accurate Quantification and Characterization of Adeno-Associated Viral Vectors – Frontiers, 7月 13, 2025にアクセス、 https://www.frontiersin.org/journals/microbiology/articles/10.3389/fmicb.2019.01570/full
- Measuring Adeno-Associated Virus (AAV) Vector Genome Titer Using Droplet Digital PCR Protocol – Bio-Rad, 7月 13, 2025にアクセス、 https://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_7407.pdf
- Quantitative and Digital Droplet-Based AAV Genome Titration – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC7377043/
- Improving Adeno-Associated Virus (AAV) vector manufacturing through process development in GMP-ready cell lines, 7月 13, 2025にアクセス、 https://ct.catapult.org.uk/resources/articles/improving-adeno-associated-virus-vector-manufacturing-through-process-development-in-gmp-ready-cell-lines
- AAV vector production: Troublesome host innate responses in another setting – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC9995278/
- AAV Vector Production Challenges Drive Innovation in Gene Therapy Manufacturing, 7月 13, 2025にアクセス、 https://trial.medpath.com/news/68eae2ce3e561f06/aav-vector-production-challenges-drive-innovation-in-gene-therapy-manufacturing
- Pre-existing anti-AAV immunity: a hidden barrier to gene therapy, 7月 13, 2025にアクセス、 https://www.gyrosproteintechnologies.com/spinblog/pre-existing-anti-aav-immunity-a-hidden-barrier-to-gene-therapy
- Immune responses to AAV vectors: Overcoming barriers to successful gene therapy, 7月 13, 2025にアクセス、 https://www.researchgate.net/publication/236225318_Immune_responses_to_AAV_vectors_Overcoming_barriers_to_successful_gene_therapy
- Readministration of high-dose adeno-associated virus gene therapy vectors enabled by ImmTOR nanoparticles combined with B cell-targeted agents, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC10673641/
- Overcoming Preexisting Humoral Immunity to AAV Using Capsid Decoys – PMC, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC4095828/
- Engineering adeno-associated virus vectors for gene therapy – PubMed, 7月 13, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/32042148/
- Systematic multi-trait AAV capsid engineering for efficient gene delivery – ResearchGate, 7月 13, 2025にアクセス、 https://www.researchgate.net/publication/382864766_Systematic_multi-trait_AAV_capsid_engineering_for_efficient_gene_delivery
- Selecting The Right Viral Vector | VectorBuilder, 7月 13, 2025にアクセス、 https://en.vectorbuilder.com/resources/faq/select-viral-vector.html
- AAV, Lentivirus, and Adenovirus: Choosing the Right Vector for Gene Therapy and Research – CD Genomics, 7月 13, 2025にアクセス、 https://www.cd-genomics.com/biomedical-ngs/resource/aav-lentivirus-adenovirus-gene-therapy-vaccine.html
- Viral Vectors 101: Types of viruses – Addgene Blog, 7月 13, 2025にアクセス、 https://blog.addgene.org/viral-vectors-101-types-of-viruses
- Risk-Benefit Analysis of the use of Viral Vectors in Gene Therapy, 7月 13, 2025にアクセス、 https://www.emich.edu/chhs/health-sciences/programs/clinical-research-administration/documents/theses/viral-vectors-in-gene-therapy.pdf
- The Ethical Implications of Gene Therapy – The Cornell Healthcare Review, 7月 13, 2025にアクセス、 https://www.cornellhealthcarereview.org/post/the-ethical-implications-of-gene-therapy
- Harvard researchers share views on future, ethics of gene editing, 7月 13, 2025にアクセス、 https://news.harvard.edu/gazette/story/2019/01/perspectives-on-gene-editing/
- THE GORDON WILSON LECTURE: THE ETHICS OF HUMAN …, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC7358513/
- Next-generation strategies to improve safety and efficacy of adeno-associated virus-based gene therapy for hemophilia – Haematologica, 7月 13, 2025にアクセス、 https://haematologica.org/article/view/haematol.2023.284622
- Ethical and practical considerations for cell and gene therapy toward an HIV cure: findings from a qualitative in-depth interview study in the United States, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC8994300/
- The ethical debate on human genome editing, 7月 13, 2025にアクセス、 https://cgsi.wisc.edu/2023/05/12/the-ethical-debate-on-human-genome-editing/
- Guidance on Biosafety Level Assignment for Adeno-Associated Virus (AAV) – University of Pittsburgh, 7月 13, 2025にアクセス、 https://www.ibc.pitt.edu/sites/default/files/untitled%20folder/ibc_guidance_-_aav_usage_revised_09_nov_20.pdf
- Recombinant adeno-associated virus safety and handling – PNI Viral Core Facility, 7月 13, 2025にアクセス、 https://vnl.princeton.edu/safety-and-handling
- VIRAL VECTOR REFERENCE GUIDE, 7月 13, 2025にアクセス、 https://cws.auburn.edu/shared/files?id=227&filename=Auburn%20University%20Viral%20Vector%20Reference%20Guide%20-%20AAV%20%26%20rAAV.pdf
- Biosafety Containment: Adeno-Associated Virus – UCSD-Blink, 7月 13, 2025にアクセス、 https://blink.ucsd.edu/safety/research-lab/biosafety/containment/adeno-bsl.html
- adenoviral-guidance.doc – Clemson University, 7月 13, 2025にアクセス、 https://media.clemson.edu/research/orc/ibc/adenoviral-guidance.doc
- Guidelines for Research Involving Viral Vectors – Environmental Health And Safety, 7月 13, 2025にアクセス、 https://ehs.uky.edu/docs/pdf/bio_viral_vectors_0001.pdf
- CDC LC Quick Learn: Recognize the four Biosafety Levels, 7月 13, 2025にアクセス、 https://www.cdc.gov/training/quicklearns/biosafety/
- Adeno-Associated Viral Vectors – Institutional Planning and Operations, 7月 13, 2025にアクセス、 https://ipo.rutgers.edu/rehs/biosafety-program/adeno-associated-viral-vectors
- Guidelines for Laboratory Biosafety: Handling and Processing Specimens Associated with Novel Influenza A Viruses, Including Potential A(H5N1) Virus | Bird Flu | CDC, 7月 13, 2025にアクセス、 https://www.cdc.gov/bird-flu/php/severe-potential/guidelines-for-laboratory-biosafety.html
- Safeguards for Using Viral Vector Systems in Human Gene Therapy: A Resource for Biosafety Professionals Mitigating Risks in Health Care Settings, 7月 13, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC9134636/
- NIH Guidelines for Research Involving Recombinant or Synthetic …, 7月 13, 2025にアクセス、 https://osp.od.nih.gov/wp-content/uploads/NIH_Guidelines.pdf
- Article – Standard for Administered A… – UNC Policies, 7月 13, 2025にアクセス、 https://policies.unc.edu/TDClient/2833/Portal/KB/ArticleDet?ID=132184
- Policies and Guidelines | Vertebrate Animal Research – The University of Iowa, 7月 13, 2025にアクセス、 https://animal.research.uiowa.edu/iacuc-policies-and-guidelines
- Immune responses to AAV vectors, from bench to bedside – Frontiers, 7月 13, 2025にアクセス、 https://www.frontiersin.org/research-topics/1212/immune-responses-to-aav-vectors-from-bench-to-bedside