はじめに
生命現象の根幹を成す細胞間の情報伝達と、それに応じた遺伝子の発現制御は、生物が環境に適応し、精巧な生命活動を維持するための基本的な仕組みです。この二つのプロセスは、長らく独立したものとして研究されてきましたが、その接点に位置し、両者を巧みに結びつける分子群が存在します。それが「核内受容体」です。核内受容体は、ホルモンやビタミンといった低分子の脂溶性シグナルを細胞内で感知する「受容体」としての顔と、その情報を基に特定の遺伝子のスイッチを直接操作する「転写因子」としての顔を併せ持つ、ユニークなタンパク質群です 1。これらの分子は、細胞膜を容易に透過するシグナルを受け取り、核内でゲノムDNAに直接作用することで、細胞の運命や機能に根本的な変化を引き起こします 1。
核内受容体の研究史における画期的な出来事の一つは、1985年にRonald M. Evans博士らの研究グループによってグルココルチコイド受容体が初めてクローニングされたことです 3。この発見は、脂溶性ホルモンがどのようにして細胞核内の遺伝子に影響を与えるのかという長年の謎を解き明かす鍵となり、核内受容体が「受容体」と「転写因子」の二重機能を持つ分子実体であることを明確に示しました。この発見以前は、「細胞外からの情報受容」と「遺伝子発現の直接制御」は、それぞれ異なる分子群が担う別個のプロセスと考えられていました。核内受容体の同定は、これらのプロセスを繋ぐミッシングリンクの発見であり、内分泌学(ホルモンの作用機序の研究)と分子生物学(遺伝子発現制御の研究)という二つの大きな学問分野が劇的に融合する瞬間を象徴していました。この発見は、細胞外環境の変化(ホルモンなど)を、細胞が遺伝子レベルでの応答に直接変換するエレガントな機構の存在を明らかにし、その後の多くのオーファン受容体(リガンドが未同定の核内受容体)の発見や、RXR(レチノイドX受容体)を中心とした複雑なシグナル伝達ネットワークの解明へと繋がり、分子内分泌学という新たな研究分野を爆発的に発展させる原動力となりました 3。
本記事では、この興味深く、かつ生命科学において極めて重要な核内受容体について、その基本的な定義から、精巧な分子メカニズム、多様なファミリーメンバー、広範な生理機能と疾患との関連、さらには最新の研究動向と今後の展望に至るまでを、国内外の研究論文 2 を参考に、初学者の方にも分かりやすく、専門家の方にも興味深い情報を提供することを目指します。核内受容体の世界への探求を通じて、生命の精緻な調節機構の一端に触れていただければ幸いです。

第1章:核内受容体 – 細胞内の情報伝達と遺伝子制御の司令塔
1.1. 核内受容体の定義:リガンドに応答する転写因子群
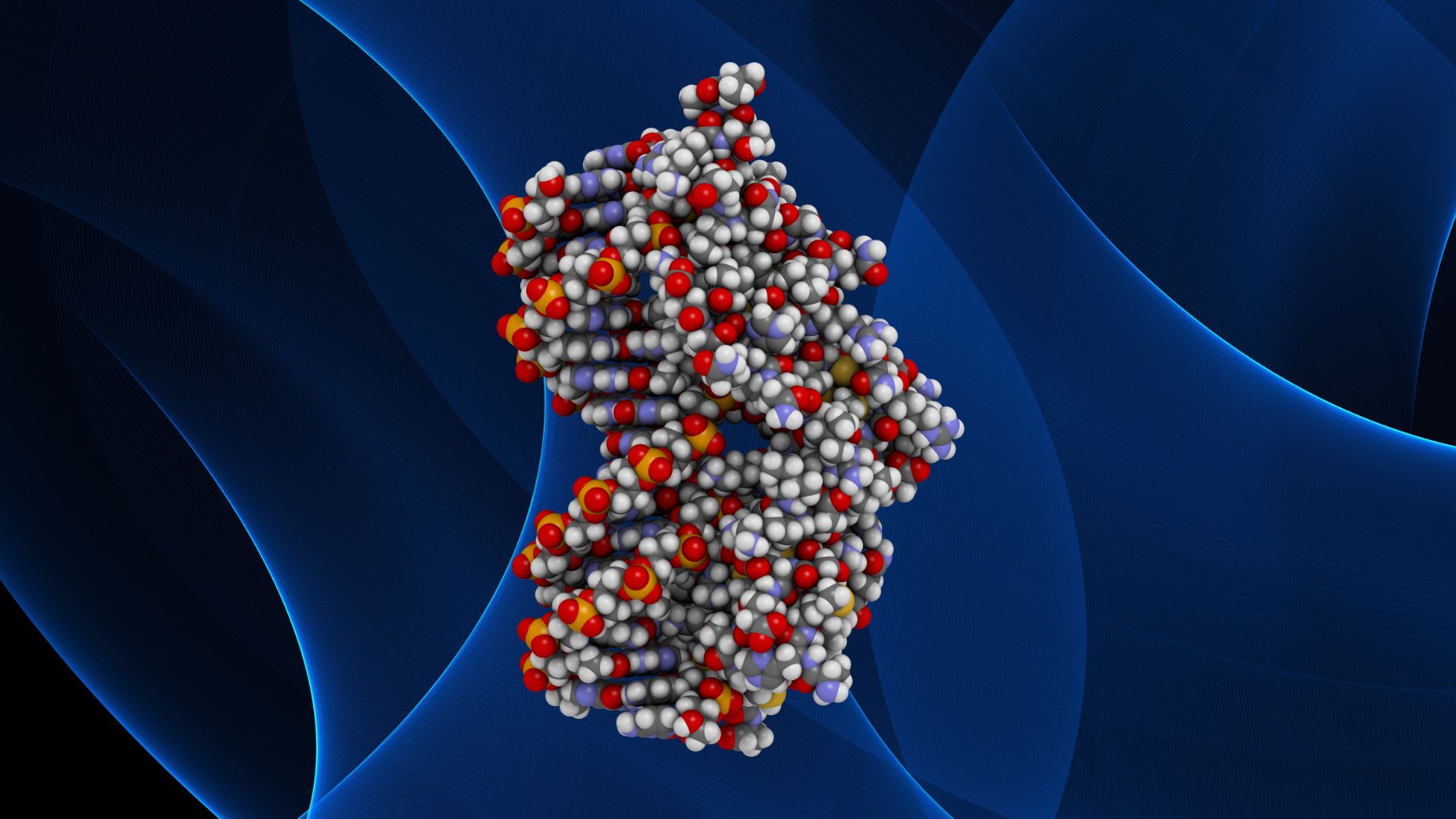
核内受容体 (Nuclear Receptor; NR) は、細胞内に存在する特殊なタンパク質群であり、特定の低分子脂溶性化合物、すなわち「リガンド」と結合することによってその活性が変化し、標的となる遺伝子の転写(DNAからRNAへの情報の写し取り)を特異的に調節する能力を持つ分子として定義されます 1。これらのリガンドには、ステロイドホルモン、甲状腺ホルモン、ビタミンAやDの活性代謝物、さらには食事由来の脂肪酸や生体内で合成される胆汁酸など、多種多様な生理活性物質が含まれます 1。ヒトのゲノムには、現在48種類の核内受容体遺伝子が存在すると考えられており 4、それぞれが異なるリガンドを認識し、異なる遺伝子群を制御することで、多彩な生命現象に関与しています。核内受容体スーパーファミリーは、進化の過程で高度に保存された構造的特徴を有しており、後生動物(多細胞動物)に特有の分子群であることが知られています 2。
1.2. 「受容体」として:ホルモンや脂溶性分子との出会い
核内受容体が「受容体」として機能する側面は、細胞外からの化学的シグナルを感知する能力にあります。ステロイドホルモン(副腎皮質ホルモン、性ホルモンなど)、甲状腺ホルモン、ビタミンD3、レチノイン酸といった古典的な内分泌シグナル分子に加え、脂肪酸、プロスタグランジン、コレステロール代謝物など、細胞の代謝状態を反映する内因性分子も核内受容体のリガンドとして同定されています 1。これらのリガンドの多くは脂溶性が高いため、細胞膜を比較的容易に通過し、細胞質内または核内に存在する対応する核内受容体と特異的に結合します 1。このリガンドと受容体の結合は、鍵と鍵穴の関係に例えられ、受容体タンパク質の立体構造(コンフォメーション)に精密な変化を引き起こします。この構造変化こそが、核内受容体が次のステップである転写因子としての活性を発揮するための引き金となるのです 2。
1.3. 「転写因子」として:標的遺伝子のスイッチを操作する
リガンドとの結合によって活性化された核内受容体は、「転写因子」としての本領を発揮します。活性化した核内受容体は、核内へと移行(細胞質に存在していた場合)し、ゲノムDNA上に存在する特定の塩基配列、すなわち「ホルモン応答配列 (Hormone Response Element; HRE)」を認識して直接結合します 1。HREに結合した核内受容体は、単独で、あるいは他のタンパク質(コファクターと呼ばれる転写補助因子群)と協調して、標的遺伝子の転写開始を促進(活性化)したり、逆に抑制したりします。この遺伝子発現のオン・オフ制御を通じて、核内受容体は細胞の代謝、成長、分化、発生、恒常性の維持、免疫応答といった、生命活動の根幹に関わる極めて広範な生理現象を精密にコントロールしているのです 2。
核内受容体のこのような二重の役割は、外部環境の化学的シグナル(リガンド)を細胞核内の遺伝情報(DNA)に直接伝達し、具体的な生命応答(遺伝子発現変化)へと変換する、極めて効率的な分子変換器であると捉えることができます。細胞膜表面の受容体がしばしば複雑な細胞内シグナル伝達カスケード(セカンドメッセンジャーやキナーゼ経路など)を介して間接的に遺伝子発現に影響を与えるのとは対照的に、核内受容体(特にクラスIIと呼ばれるタイプ)は、シグナルからゲノム応答へのより直接的な経路を提供します。この直接性は、特定の生理的合図に対する正確かつ迅速な細胞の適応を可能にします。また、脂溶性リガンドが細胞内に入り込みゲノムに直接作用するという特性は、水溶性シグナルが利用する細胞表面のシグナル伝達経路をバイパスする必要がある場合に、進化的に選択された適応戦略であると考えられます。この直接的な作用機序は、核内受容体を強力な創薬ターゲットたらしめている理由の一つでもあり、その活性を調節することで遺伝子発現に即時的かつ顕著な効果を期待できるのです。
第2章:核内受容体の精巧な分子メカニズム
核内受容体がリガンドを感知し、標的遺伝子の発現を精密に制御する能力は、その独特なドメイン構造と、段階的かつ協調的な活性化プロセスに由来します。
2.1. 構造の妙:機能ドメイン (NTD, DBD, Hinge, LBD, AF-1, AF-2) とその役割
核内受容体はモジュール構造をとっており、それぞれ異なる機能を持つ複数のドメインから構成されています。これらのドメインが連携することで、リガンド認識からDNA結合、転写制御に至る一連の機能が発揮されます(表1参照)。
- N末端ドメイン (A/B領域; NTD – N-terminal Domain): 受容体分子のN末端に位置し、アミノ酸配列や長さの多様性が最も大きい領域です 2。この領域には、リガンドとは非依存的に転写を活性化する能力を持つ「活性化機能1 (Activation Function-1; AF-1)」と呼ばれる配列が含まれています 2。AF-1の活性は細胞種やプロモーターの種類によって異なり、他の転写因子やコファクターとの相互作用に重要な役割を果たします 61。
- DNA結合ドメイン (C領域; DBD – DNA-Binding Domain): 核内受容体ファミリー間でアミノ酸配列の保存性が非常に高い領域です 2。このドメインは、2つの「ジンクフィンガー」と呼ばれる特徴的な構造を含んでいます。各ジンクフィンガーは亜鉛イオン (Zn2+) を中心にタンパク質が折りたたまれた構造をとり、これらがDNA上の特異的な塩基配列であるホルモン応答配列 (HRE) を正確に認識し、結合するのに必須です 2。
- ヒンジ領域 (D領域 – Hinge Region): DBDと後述するリガンド結合ドメイン (LBD) を繋ぐ柔軟なリンカー領域です 2。この領域の柔軟性は、受容体のDNAへの結合や二量体形成、さらには核内への移行を助けると考えられています。一部の受容体では、核移行シグナル (Nuclear Localization Signal; NLS) がこの領域に含まれています 63。
- リガンド結合ドメイン (E/F領域; LBD – Ligand-Binding Domain): 受容体分子のC末端側に位置し、特異的なリガンドを認識して結合するポケット構造を持つ領域です 2。LBDもファミリー内で比較的よく保存されています。リガンドが結合すると、LBDの立体構造が大きく変化し、これが受容体活性化のスイッチとなります。この構造変化は、受容体の二量体形成、コファクターとの相互作用、そして「活性化機能2 (Activation Function-2; AF-2)」と呼ばれるリガンド依存的な転写活性化領域の機能発現に不可欠です 2。AF-2領域は、特にコアクチベーターと呼ばれる転写促進補助因子群との結合に重要です。
AF-1とAF-2は、ともに転写活性化に寄与しますが、そのメカニズムや重要性は異なります。AF-1はリガンド非依存的に機能し、その活性はリン酸化などの翻訳後修飾によって調節されることが多く、細胞種特異的な転写制御に関与します。一方、AF-2はリガンド結合に依存して活性化され、LBDの構造変化を介してコアクチベーターをリクルートします。多くの核内受容体では、AF-1とAF-2が協調的に働くことで、最大限の転写活性が発揮されると考えられています 2。
表1:核内受容体のドメイン構造と機能の概要
| ドメイン名 (領域) | 別名 | 主要な構造的特徴 | 主要な機能 | 保存性 |
| A/B領域 | N末端ドメイン (NTD) | 多様性に富む、しばしば非構造化 | AF-1 (リガンド非依存的転写活性化)、コファクター結合、細胞種特異的制御 | 低い |
| C領域 | DNA結合ドメイン (DBD) | 2つのジンクフィンガー構造 | HREの特異的認識と結合 | 非常に高い |
| D領域 | ヒンジ領域 | 柔軟なリンカー | DBDとLBDの連結、核移行、二量体形成への寄与 | 可変 |
| E/F領域 | リガンド結合ドメイン (LBD) | αヘリックスに富む立体構造、リガンド結合ポケット | リガンド結合、AF-2 (リガンド依存的転写活性化)、二量体形成、コファクター結合、リガンドによるコンフォメーション変化 | 高い |
2.2. 活性化のステップ
核内受容体の活性化は、リガンド結合から始まり、DNA結合、コファクターのリクルート、そして最終的な転写制御に至る、一連の精密に制御されたステップを経て進行します。
2.2.1. リガンド結合とコンフォメーション変化
最初のステップは、特異的なリガンドとの結合です。脂溶性の高いリガンドは細胞膜を通過し、細胞質または核内に存在する対応する核内受容体に到達します 1。リガンドがLBD内の特異的なポケットに結合すると、LBD全体の立体構造に劇的な変化(コンフォメーション変化)が誘導されます。この変化は、特にLBDを構成する複数のαヘリックス(例えば、ヘリックス3、11、12など 6)の再配置を伴い、AF-2領域の構造を活性型へとシフトさせます。これにより、それまで隠れていたコアクチベーターとの結合面が露出し、あるいは結合していたコリプレッサーが解離する準備が整います 2。
2.2.2. DNA上の応答配列 (HRE) への結合
リガンド結合によって活性型コンフォメーションへと変化した核内受容体(またはその二量体)は、次に標的遺伝子のDNAへと向かいます。ゲノムDNA上には、核内受容体が特異的に認識して結合するための短い塩基配列が存在し、これをホルモン応答配列 (HRE) と呼びます 2。HREは通常、遺伝子の転写開始点の上流にあるプロモーター領域や、より離れた位置にあるエンハンサー領域に存在します。HREの塩基配列や、HREを構成するハーフサイト(受容体モノマーが結合する単位配列)の向き(同方向反復、逆方向反復など)や間隔の塩基数は、どの核内受容体が結合できるかを決定する重要な要素であり、受容体ごとの標的遺伝子の特異性を生み出す基盤となっています。
2.2.3. 多様な二量体形成:RXRの中心的役割
多くの核内受容体は、単独 (モノマー) ではなく、二つの受容体分子がペアを組んだ二量体 (ダイマー) として機能します 2。この二量体形成には、同じ種類の受容体同士が結合するホモ二量体と、異なる種類の受容体が結合するヘテロ二量体があります。
- クラスI核内受容体(ステロイドホルモン受容体など):主にホモ二量体を形成し、リガンドが結合していない状態では細胞質に存在し、熱ショックタンパク質 (HSP) などと複合体を形成しています。リガンドが結合するとHSPが解離し、核内へ移行してHREに結合します 2。
- クラスII核内受容体(甲状腺ホルモン受容体、ビタミンD受容体、レチノイン酸受容体など):リガンドの有無にかかわらず常に核内に存在し、多くの場合、レチノイドX受容体 (RXR) と呼ばれる別の核内受容体とヘテロ二量体を形成してHREに結合しています 2。
RXRは、ヒトに存在する48種類の核内受容体のうち約3分の1のパートナーとして機能し、多様なシグナル伝達経路が交差するハブとしての中心的な役割を担っています 6。RXRとのヘテロ二量体形成は、シグナル伝達の多様性と特異性を高める上で非常に重要です。RXRとそのパートナー受容体の組み合わせによって、認識するHREの配列や、リガンド応答性が変化します。例えば、RXRアゴニスト(作動薬)単独で活性化できる「permissive」なヘテロ二量体、パートナー受容体のアゴニスト存在下でのみRXRアゴニストによる活性化が認められる「conditional permissive」なヘテロ二量体、そしてRXRアゴニストによっては活性化されない「non-permissive」なヘテロ二量体が存在します 6。このようなRXRの広範なパートナーシップは、異なるシグナル伝達経路間のクロストークと統合を可能にする分子基盤を提供しており、RXR自体が重要な治療標的となりうることを示唆しています。RXRを介したシグナル統合は、細胞が複数の外部刺激に対して協調的かつ適切な応答を生み出すために不可欠であり、この複雑なネットワークの破綻は様々な疾患に関与すると考えられます。従って、RXRの機能を特異的に調節する薬剤は、複数の核内受容体経路が関与する疾患(例えばメタボリックシンドロームや一部のがん)に対して、広範かつ効果的な治療戦略を提供する可能性がありますが、同時にその広範な影響力ゆえに副作用のリスクも慎重に評価する必要があります。
2.2.4. コファクター群 (コアクチベーター、コリプレッサー) との連携
核内受容体が遺伝子の転写を制御する際には、「コファクター」と呼ばれる一群の補助タンパク質の助けを借ります。コファクターは、転写を促進する「コアクチベーター」と、転写を抑制する「コリプレッサー」に大別されます。
- コリプレッサー: リガンドが結合していない状態の一部のクラスII核内受容体(TRやRARなど)は、コリプレッサー複合体(NCoRやSMRTなどを含む)と結合しています 6。これらのコリプレッサーは、しばしばヒストン脱アセチル化酵素 (HDAC) 活性を持ち、標的遺伝子周辺のクロマチン構造を凝縮させ、転写を抑制状態に保ちます 7。
- コアクチベーター: リガンドが核内受容体に結合し、その立体構造が変化すると、コリプレッサーが解離し、代わりにコアクチベーター複合体(CBP/p300やSRC-1/p160ファミリーなどを含む)がリクルートされます 6。コアクチベーターは、ヒストンアセチル基転移酵素 (HAT) 活性を持つものや、クロマチン構造を緩めて転写装置(RNAポリメラーゼIIなど)がDNAにアクセスしやすくするクロマチンリモデリング因子を含んでおり、標的遺伝子の転写を強力に促進します 7。
このように、リガンド依存的なコリプレッサーとコアクチベーターの交換は、核内受容体による遺伝子発現制御の中心的メカニズムの一つです。
2.2.5. リン酸化など翻訳後修飾による活性制御の深化
核内受容体の活性は、リガンド結合だけでなく、リン酸化、アセチル化、ユビキチン化、SUMO化といった様々な翻訳後修飾 (Post-Translational Modification; PTM) によっても複雑かつ精密に制御されています 8。これらの修飾は、受容体の安定性、細胞内局在、DNA結合能、リガンド親和性、そしてコファクターとの相互作用に影響を与え、結果として転写活性を変化させます。
特にリン酸化は、核内受容体機能の重要な調節因子として注目されています。例えば、レチノイン酸受容体γ2 (RARγ2) の特定のセリン残基 (セリン379) が、細胞間接着分子であるクローディン6 (CLDN6) からのシグナルによって活性化されるSFK/PI3K/AKTキナーゼ経路を介してリン酸化されると、RARγ2のリガンドであるレチノイン酸 (RA) に対する感受性が著しく向上し、幹細胞の上皮細胞への分化が効率的に誘導されることが報告されています 8。同様のメカニズムはエストロゲン受容体α (ERα) でも見られ、ERαの対応するセリン残基 (セリン518) のリン酸化が、乳がん細胞や子宮体がん細胞の増殖や悪性化を促進する可能性が示されています 8。
これらの発見は、核内受容体の活性制御が、従来考えられていたリガンド依存的なオン・オフスイッチという単純なものではなく、細胞内外の多様なシグナル伝達経路とクロストークし、翻訳後修飾を介してその活性がダイナミックに調節される、より洗練されたシステムであることを示しています。リガンド、コファクター、翻訳後修飾、そして標的遺伝子のクロマチン環境といった複数の要因が複雑に絡み合い、最終的な転写出力を決定しているのです。この複雑な制御ネットワークの理解は、核内受容体を標的としたより効果的で特異的な治療法開発に繋がる可能性があります。
2.2.6. エピジェネティック制御:クロマチン構造変化と遺伝子発現
核内受容体による転写制御の最終的な舞台は、DNAがヒストンタンパク質に巻き付いて形成されるクロマチン構造です。核内受容体は、リクルートしたコファクター群を介して、このクロマチン構造をダイナミックに変化させることで遺伝子発現を制御します。これはエピジェネティック制御の一環と考えられます。
コアクチベーターはヒストンアセチル化酵素 (HAT) 活性を持ち、ヒストンタンパク質の特定のリジン残基をアセチル化します。ヒストンのアセチル化は、クロマチン構造を緩め(脱凝縮)、転写因子やRNAポリメラーゼといった基本転写装置がDNAにアクセスしやすくなるため、一般的に転写を活性化します 7。逆に、コリプレッサーはヒストン脱アセチル化酵素 (HDAC) 活性を持ち、ヒストンのアセチル基を除去することでクロマチン構造を凝縮させ、転写を抑制します 7。
ヒストンのアセチル化/脱アセチル化以外にも、ヒストンのメチル化/脱メチル化、リン酸化、ユビキチン化といった多様な修飾が、核内受容体による転写制御に関与します。さらに、ATP依存的なクロマチンリモデリング複合体も核内受容体によってリクルートされ、ヌクレオソームの位置を移動させたり、構造を変化させたりすることで、遺伝子のオン・オフを調節します 7。DNAメチル化といった他のエピジェネティック修飾も、核内受容体の結合や機能に影響を与えることが知られています 29。
近年では、長鎖ノンコーディングRNA (lncRNA) が、核内受容体やコファクターを特定のエピジェネティック修飾酵素(ヒストンメチル化酵素や脱メチル化酵素など)と共に標的遺伝子領域にリクルートしたり、クロマチンループ形成などの3次元ゲノム構造の制御に関与したりすることで、核内受容体による遺伝子発現制御に新たな層を加えていることが明らかになりつつあります 29。これらのエピジェネティックなメカニズムは、核内受容体が細胞の状況に応じて、持続的かつ安定的な遺伝子発現パターンを確立するために不可欠です。
核内受容体の活性制御は、リガンドの有無という単純なオン・オフスイッチではなく、リガンドの種類や濃度、共存するコファクターの種類と量、翻訳後修飾の状態、さらには標的遺伝子のクロマチン環境といった複数の要因が絡み合う、高度に統合されたシステムです。この複雑性が、核内受容体が多様な生理現象において、状況に応じた柔軟かつ精密な遺伝子発現制御を可能にしている理由と言えるでしょう。
第3章:核内受容体スーパーファミリー – 多様なメンバーとその特徴
核内受容体は単一の分子ではなく、共通の構造的特徴を持ちながらも、それぞれが異なるリガンドを認識し、異なる生理機能を担う巨大なタンパク質ファミリー(スーパーファミリー)を形成しています。
3.1. 進化の産物:48種類(ヒト)のメンバーからなる一大ファミリー
核内受容体スーパーファミリーは、進化の過程で共通の祖先遺伝子から遺伝子重複と機能分化を経て誕生したと考えられています 3。その結果、特にDNA結合ドメイン (DBD) とリガンド結合ドメイン (LBD) において構造上の高い類似性を保ちつつも、リガンド特異性や標的遺伝子の選択性において著しい多様性を獲得しました 2。ヒトゲノムには48種類の核内受容体遺伝子が存在し 4、これらはそのリガンド結合特性、DNA結合様式(HREの配列や結合する際の二量体の種類)、そして二量体形成のパートナーに基づいて、いくつかのクラスまたはサブファミリーに分類されます 2。
主要な分類法の一つとして、以下の4つのクラスが提唱されています 9:
- ステロイド受容体 (Class I): グルココルチコイド受容体 (GR)、ミネラルコルチコイド受容体 (MR)、アンドロゲン受容体 (AR)、プロゲステロン受容体 (PR)、エストロゲン受容体 (ER) などが含まれます。これらは主にホモ二量体(同じ受容体同士のペア)を形成し、逆方向反復配列 (Inverted Repeat; IR) からなるHREに結合します。リガンド非結合時は細胞質に存在し、リガンド結合後に核へ移行するものが多いです 2。
- RXRヘテロ二量体 (Class II): 甲状腺ホルモン受容体 (TR)、ビタミンD受容体 (VDR)、レチノイン酸受容体 (RAR)、ペルオキシソーム増殖因子活性化受容体 (PPAR)、肝臓X受容体 (LXR)、ファルネソイドX受容体 (FXR) などが含まれます。これらはレチノイドX受容体 (RXR) とヘテロ二量体(異なる受容体とのペア)を形成し、主に同方向反復配列 (Direct Repeat; DR) からなるHREに結合します。リガンドの有無に関わらず核内に存在し、DNAに結合していることが多いです 2。
- ホモ二量体オーファン受容体 (Class III): 主にオーファン受容体(リガンド未同定の受容体)が含まれ、ホモ二量体としてDR型のHREに結合するものが分類されます。例としてCOUP-TFファミリーなどが挙げられます 9。
- モノマーオーファン受容体 (Class IV): これも主にオーファン受容体で構成され、単量体 (モノマー) として伸長したHREハーフサイトに結合します。例としてNGFI-BファミリーやRORファミリーなどが挙げられます 9。
この分類は絶対的なものではなく、一部の受容体は複数のクラスにまたがるような挙動を示すこともありますが、核内受容体の多様な作用様式を理解する上で有用な枠組みとなります。
表2:主要な核内受容体の分類、代表的リガンド、生理機能
| 受容体クラス | 受容体名 (略称) | 代表的リガンド | 主要な生理機能 |
| ステロイド受容体 (Class I) | エストロゲン受容体 (ERα, ERβ) | エストラジオール、エストロン | 性分化、生殖機能、二次性徴、骨代謝、乳腺・子宮の発達、がん(乳がん、子宮体がん) |
| アンドロゲン受容体 (AR) | テストステロン、ジヒドロテストステロン | 男性の性分化・生殖機能、二次性徴、筋肉・骨の発達、前立腺機能、がん(前立腺がん) | |
| グルココルチコイド受容体 (GR) | コルチゾール、コルチコステロン | 糖・脂質・タンパク質代謝、免疫抑制、抗炎症作用、ストレス応答 | |
| ミネラルコルチコイド受容体 (MR) | アルドステロン、コルチゾール | 電解質バランス(Na⁺, K⁺)調節、血圧調節 | |
| プロゲステロン受容体 (PR) | プロゲステロン | 女性生殖機能(月経周期、妊娠維持、乳腺発達) | |
| RXRヘテロ二量体 (Class II) | 甲状腺ホルモン受容体 (TRα, TRβ) | トリヨードサイロニン (T3)、サイロキシン (T4) | 成長・発生、代謝亢進(基礎代謝、熱産生)、神経系発達 |
| ビタミンD受容体 (VDR) | 1,25-ジヒドロキシビタミンD3 (活性型ビタミンD3) | カルシウム・リン代謝調節、骨形成・維持、免疫調節、細胞増殖・分化制御 | |
| レチノイン酸受容体 (RARα, RARβ, RARγ) | オールトランスレチノイン酸 (ATRA)、9-シスレチノイン酸 | 胚発生、細胞増殖・分化、視覚、皮膚・粘膜の維持、免疫機能 | |
| ペルオキシソーム増殖因子活性化受容体 (PPARα, PPARβ/δ, PPARγ) | 脂肪酸、エイコサノイド、フィブラート系薬剤 (PPARα)、チアゾリジン系薬剤 (PPARγ) | 脂質代謝(脂肪酸酸化、トリグリセリド低下)、糖代謝(インスリン感受性改善)、脂肪細胞分化、炎症制御 | |
| 肝臓X受容体 (LXRα, LXRβ) | オキシステロール(コレステロール代謝物) | コレステロール代謝・排泄促進、脂質代謝、炎症制御 | |
| ファルネソイドX受容体 (FXR) | 胆汁酸(ケノデオキシコール酸など) | 胆汁酸代謝・恒常性維持、脂質・糖代謝、肝保護作用 | |
| レチノイドX受容体 (RXRα, RXRβ, RXRγ) | 9-シスレチノイン酸 | Class II受容体のヘテロ二量体パートナーとして機能、ホモ二量体としても機能 | |
| オーファン受容体 | エストロゲン関連受容体 (ERRα, ERRβ, ERRγ) | リガンド未同定(構成的活性型、またはタンパク質間相互作用で制御) | エネルギー代謝(ミトコンドリア機能、酸化的リン酸化)、発生、がん |
| Nur77 (NR4A1), Nurr1 (NR4A2), NOR-1 (NR4A3) | リガンド未同定(様々な刺激で誘導) | 細胞増殖・アポトーシス、炎症、ストレス応答、神経機能(Nurr1はドーパミン神経細胞の発生・維持)、がん(Nur77は二面性) | |
| 肝細胞核因子4 (HNF4α, HNF4γ) | 脂肪酸(内因性リガンドとして議論あり) | 肝臓・膵臓・腎臓・腸の発生と機能維持、糖・脂質代謝 | |
| 鶏卵白アルブミン上流プロモーター転写因子 (COUP-TF I, II, III) | リガンド未同定 | 神経発生、器官形成、代謝、生殖 | |
| 副腎皮質刺激ホルモン放出因子受容体様オーファン受容体 (RORα, RORβ, RORγ) | コレステロール (RORα)、メラトニン (RORα)、リガンド未同定/構成的活性 (RORγ) | 概日リズム、免疫応答 (Th17細胞分化: RORγt)、代謝、発生 | |
| Rev-erbα (NR1D1), Rev-erbβ (NR1D2) | ヘム | 概日リズムの抑制因子、代謝、炎症 |
3.2. 古典的受容体:ステロイドホルモン、甲状腺ホルモン、ビタミンD、レチノイン酸の受容体
核内受容体スーパーファミリーの中でも、そのリガンドが古くから知られているホルモンやビタミンである一群は「古典的受容体」と総称されます。これらは生命維持に不可欠な多様な生理機能の調節に深く関わっています。
- エストロゲン受容体 (ER): 主にERαとERβのサブタイプが存在し、近年ではGタンパク質共役型エストロゲン受容体1 (GPER1) も注目されています 17。女性の性分化、生殖器の発達と機能維持、月経周期、妊娠、二次性徴の発現に加え、骨代謝の維持、脂質代謝、心血管系の保護、脳機能にも重要な役割を果たします。ERの機能異常は、乳がん、子宮体がん、卵巣がんなどの婦人科系がん、骨粗鬆症、更年期障害などと関連します 8。
- アンドロゲン受容体 (AR): 主に男性ホルモンであるテストステロンやジヒドロテストステロン (DHT) に応答し、男性の胎生期における性分化、精巣や前立腺などの男性生殖器の発達と機能維持、精子形成、二次性徴(筋肉の発達、体毛、声変わりなど)を制御します。ARの異常は、男性不妊症や前立腺がん、アンドロゲン不応症などに関与します 62。
- グルココルチコイド受容体 (GR): 副腎皮質から分泌されるグルココルチコイド(コルチゾールなど)に応答し、糖代謝(血糖値上昇)、脂質代謝、タンパク質代謝の調節、強力な免疫抑制作用と抗炎症作用、ストレス応答など、生体の恒常性維持に極めて重要な役割を担います。医薬品としては、デキサメタゾンなどの合成グルココルチコイドが抗炎症薬や免疫抑制薬として広く用いられています 16。
- ミネラルコルチコイド受容体 (MR): 主にアルドステロンに応答し、腎臓におけるナトリウムの再吸収とカリウムの排泄を促進することで、体液量と電解質バランス、ひいては血圧を調節します。
- プロゲステロン受容体 (PR): 女性ホルモンであるプロゲステロンに応答し、子宮内膜の分化、月経周期の調節、妊娠の成立と維持、乳腺の発達など、女性の生殖機能に中心的な役割を果たします。
- 甲状腺ホルモン受容体 (TR): 甲状腺ホルモン(T3、T4)に応答し、TRαとTRβのサブタイプが存在します。全身の細胞の代謝活性を高め、成長、発生(特に脳神経系の発達)、体温調節など、広範な生理作用を示します 62。
- ビタミンD受容体 (VDR): 活性型ビタミンD3 (1,25-ジヒドロキシビタミンD3) に応答します。主な機能は腸管からのカルシウムとリンの吸収促進、骨の石灰化と再構築(リモデリング)の調節ですが、近年では免疫系の調節、細胞増殖・分化の制御、がん予防など、骨代謝以外の多様な作用(多面的作用)も注目されています 8。
- レチノイン酸受容体 (RAR) および レチノイドX受容体 (RXR): ビタミンAの活性代謝物であるレチノイン酸に応答します。RARにはRARα、RARβ、RARγ、RXRにはRXRα、RXRβ、RXRγのサブタイプが存在します。これらは細胞の増殖、分化、アポトーシス(プログラム細胞死)の制御、胚発生における形態形成、視覚機能、免疫応答、皮膚や粘膜の維持など、極めて多彩な生命現象に関与します。特にRXRは、他の多くの核内受容体(TR、VDR、RAR、PPARなど)とヘテロ二量体を形成する共通のパートナーとして、シグナル伝達の統合に重要な役割を果たします 3。
3.3. オーファン受容体:未知のリガンドを求めて – 機能解明と創薬への期待
核内受容体スーパーファミリーの中には、その構造が既知の受容体と類似しているものの、生体内での生理的なリガンドがまだ同定されていない、あるいはリガンドが結合するかどうかすら不明なメンバーが多数存在します。これらは「オーファン核内受容体(オーファン受容体)」と呼ばれます 3。オーファン受容体の発見は、1980年代後半から始まり、核内受容体研究に新たなフロンティアを切り開きました。
オーファン受容体の機能解明は、「リバースエンドクリノロジー(逆内分泌学)」と呼ばれるアプローチによって進められてきました。これは、従来のホルモン発見から受容体同定へという流れとは逆に、まず受容体遺伝子を同定し、その受容体を活性化する未知のリガンドを探索し、リガンドを手がかりに生理機能を解明していくという戦略です 3。また、遺伝子改変マウス(ノックアウトマウスやトランスジェニックマウス)を用いた解析は、リガンドが不明なオーファン受容体の生体内での役割を明らかにする上で強力な手段となっています 38。
これらの研究努力により、多くのオーファン受容体が、代謝、発生、免疫、神経機能など、様々な生命現象において重要な役割を担っていることが明らかになりつつあります。以下に代表的な例を挙げます。
- ERR (Estrogen-Related Receptor; エストロゲン関連受容体): ERRα、ERRβ、ERRγの3つのサブタイプが存在します。名前に「エストロゲン」とありますが、エストロゲンとは結合しません。主にエネルギー代謝、特にミトコンドリアの生合成と機能、酸化的リン酸化の制御に深く関与しています。特にERRαは、転写コアクチベーターであるPGC-1αやPGC-1βと協調して、これらの代謝経路を活性化することが知られています 10。
- Nur77 (NR4A1), Nurr1 (NR4A2), NOR-1 (NR4A3): NR4Aサブファミリーを形成し、細胞増殖、アポトーシス、炎症応答、ストレス応答、神経機能など、非常に多様な細胞プロセスに関与します。Nurr1は特に中脳ドーパミン作動性ニューロンの発生、分化、生存に必須であり、パーキンソン病との関連が注目されています。Nur77は、がんの種類や細胞環境によって、がん抑制的に働く場合と、逆にがん促進的に働く場合があるという二面性を持つことが報告されています 12。
- LRH-1 (Liver Receptor Homolog-1; NR5A2) および SF-1 (Steroidogenic Factor-1; NR5A1): 発生初期の胚発生、ステロイドホルモン産生細胞の分化と機能維持、肝臓における胆汁酸合成や脂質代謝、膵臓β細胞の機能、さらには胚性幹細胞 (ES細胞) の多能性維持などに関与しています。
- TR4 (Testicular Receptor 4; NR2C2): 他の核内受容体(AR、ERα、PPARα、RXRなど)の機能を負に調節するモジュレーターとして働き、前立腺がん、乳がん、鎌状赤血球症などとの関連が示唆されています 39。
オーファン受容体のリガンドを同定する「デオーファナイゼーション」の研究は、新たな生理活性物質の発見や、これまで治療法がなかった疾患に対する新規創薬標的の提供に繋がる可能性を秘めているため、世界中で精力的に進められています 6。
オーファン受容体の存在は、我々がまだ全容を把握していない未知のシグナル伝達経路や生理調節メカニズムが、生体内に数多く隠されていることを力強く示唆しています。ヒトゲノムにコードされる48種類の核内受容体のうち、かなりの数が当初オーファン受容体として同定され、その多くは依然として生理的リガンドが不明であるか、議論の余地があります 37。核内受容体はリガンド依存的に活性化される転写因子であり、そのリガンドこそが機能の「鍵」であると考えると、鍵が未発見の受容体の存在は、未発見の生理的シグナル(鍵)が体内に存在することを意味します。これらの未知のシグナルや、それらが制御する生命現象を解き明かすことは、生命科学におけるまさにフロンティア領域であり、基礎生物学の進展のみならず、新たな疾患治療法の開発にも繋がる大きな可能性を秘めています。
第4章:生命現象を司る核内受容体 – 生理機能と疾患
核内受容体スーパーファミリーは、個体の発生から成熟、そして老化に至るまで、生命活動のあらゆる局面で中心的な役割を果たしています。その機能は多岐にわたり、バランスが崩れると様々な疾患の発症に繋がります。
4.1. 発生・分化から代謝・免疫まで:広範な生命活動への関与
核内受容体は、細胞の基本的な運命決定から、個体レベルでの複雑な生理機能の維持に至るまで、驚くほど広範な生命活動に関与しています。
- 発生・分化: 個体の形態形成や特定の細胞・組織への分化は、核内受容体によって厳密に制御されています。例えば、レチノイン酸受容体 (RAR) は脊椎動物の前後軸パターン形成や神経堤細胞の分化に、甲状腺ホルモン受容体 (TR) は両生類の変態や哺乳類の脳神経系の成熟に、ビタミンD受容体 (VDR) は骨格形成や免疫細胞の分化に不可欠です 5。これらの受容体は、発生段階で特定の遺伝子群の発現タイミングと量を精密に調節することで、複雑な生命の設計図を実現します。
- 代謝調節: 生体のエネルギーバランスと栄養素の利用は、複数の核内受容体によって巧妙にコントロールされています。
- 脂質代謝: ペルオキシソーム増殖因子活性化受容体 (PPARs) は、脂肪酸の取り込み、貯蔵、異化(燃焼)を制御し、特にPPARγは脂肪細胞の分化とインスリン感受性に中心的です 16。肝臓X受容体 (LXRs) はコレステロールの代謝と排泄を促進し、ファルネソイドX受容体 (FXR) は胆汁酸の合成と恒常性を維持します 11。これらの受容体の連携により、血中脂質レベルや体脂肪量が適切に保たれます。
- 糖代謝: グルココルチコイド受容体 (GR) は、空腹時などに肝臓での糖新生を促進し血糖値を上昇させます 16。PPARγはインスリン感受性を高めることで血糖降下作用に関与します 16。
- エネルギー恒常性: エストロゲン関連受容体α (ERRα) は、ミトコンドリアの機能と酸化的リン酸化を制御し、細胞のエネルギー産生に貢献します 24。
- 生殖: エストロゲン受容体 (ER)、アンドロゲン受容体 (AR)、プロゲステロン受容体 (PR) は、性ホルモンに応答し、性分化、生殖器の発達、配偶子(精子・卵子)形成、性周期、妊娠の成立と維持、二次性徴の発現など、生殖に関わる一連のプロセスを支配しています 17。
- 恒常性維持: ミネラルコルチコイド受容体 (MR) は腎臓でのナトリウム再吸収を介して体液量と血圧を調節し、GRはストレス応答時に生体の適応反応を誘導するなど、内部環境の安定化に寄与します 21。
- 炎症・免疫応答: 核内受容体は炎症反応と免疫系の制御においても重要な役割を担います。GRは最も強力な内因性の抗炎症・免疫抑制因子の一つです 16。PPARsは炎症性サイトカインやケモカインの産生を抑制し、VDRは免疫細胞の分化や機能を調節することで免疫寛容や感染防御に関与します 16。LXRはマクロファージの活性化や脂質代謝を介して炎症応答を制御します 16。このように、核内受容体は炎症の開始、進行、収束の各段階で複雑に関与しています 16。
- サーカディアンリズム(概日リズム): Rev-erbα/βやRORsといった核内受容体は、約24時間周期の生命活動リズム(睡眠覚醒、ホルモン分泌、代謝など)を生み出す分子時計の構成要素として、あるいはその調節因子として機能し、生体リズムの維持に貢献しています 38。
4.2. バランスの破綻と疾患:がん、生活習慣病、炎症性疾患、神経変性疾患との関連
核内受容体によって精巧に制御されている生命現象のバランスが、遺伝的要因や環境要因によって破綻すると、様々な疾患の発症に繋がります。核内受容体の発現量の異常、遺伝子変異による機能変化、あるいは関連するシグナル伝達経路の障害は、広範な疾患の病態形成に関与しています 11。
- がん: 多くの核内受容体が、がん細胞の増殖、生存、アポトーシス回避、血管新生、浸潤・転移といった、がんの発生と進行の様々な段階に関与しています 33。例えば、ERは乳がんや子宮体がんの約7割で発現しており、エストロゲン依存的な増殖を促進します 8。ARは前立腺がんの発生と進行に中心的です 18。RARの異常は急性前骨髄球性白血病 (APL) の原因となります。VDRは、大腸がんや乳がんなど一部のがんに対して予防的な効果を持つ可能性が示唆されています 20。オーファン受容体であるNur77は、がん種や細胞の状況によって、がん抑制的に働くこともあれば、逆にがん促進的に働くこともあるという複雑な役割が報告されています 12。
- 生活習慣病(メタボリックシンドローム、糖尿病、脂質異常症、肥満): PPARs (特にPPARγとPPARα)、LXRs、FXR、GR、TRといった核内受容体は、糖代謝や脂質代謝の調節に深く関わっており、これらの機能異常はインスリン抵抗性、高血糖、脂質異常、脂肪蓄積などを引き起こし、メタボリックシンドロームや2型糖尿病、非アルコール性脂肪性肝疾患 (NAFLD/NASH) などの発症・進展に繋がります 16。
- 炎症性疾患・自己免疫疾患: GRの抗炎症作用は、関節リウマチや気管支喘息などの治療に利用されています 16。PPARsは炎症性腸疾患 (IBD) の病態に関与し、そのリガンドが治療薬候補として研究されています 16。VDRは、多発性硬化症やIBDなどの自己免疫疾患において免疫調節機能の異常との関連が指摘されています。オーファン受容体であるRORγtは、炎症性サイトカインIL-17を産生するTh17細胞の分化に必須であり、自己免疫疾患の新たな治療標的として注目されています 38。
- 神経変性疾患: 核内受容体は神経系の発生、機能維持、保護にも関与しており、その機能不全は神経変性疾患の病態に関わることが示唆されています。ERは、アルツハイマー病の発症リスク低下や進行抑制に保護的に働く可能性が研究されています 11。PPARsは、アルツハイマー病やパーキンソン病において、アミロイドβの蓄積抑制、神経炎症の軽減、神経保護作用などを示す可能性が報告されています 11。オーファン受容体Nurr1はドーパミン神経細胞の生存に重要であり、パーキンソン病の治療標的として期待されています 12。LXRは脳内コレステロール代謝やアミロイドβクリアランスに関与し、アルツハイマー病との関連が研究されています 11。これらの受容体は、神経細胞におけるアミロイドβタンパク質の沈着、タウタンパク質のリン酸化、ミクログリアやアストロサイトによる神経炎症、酸化ストレス、神経細胞死といった、神経変性疾患に共通する病理プロセスに影響を与えることが分かってきています 11。
- 骨疾患: ERの機能低下は閉経後骨粗鬆症の主要な原因の一つです 18。VDRの欠損や機能不全は、カルシウム吸収不良によるくる病(小児)や骨軟化症(成人)、骨粗鬆症を引き起こします 19。
核内受容体は、単一の遺伝子やタンパク質の異常が、まるでドミノ倒しのように連鎖反応を引き起こし、広範な生理機能に影響を及ぼしうる「ハブ分子」としての側面を持っています。これは、一つの核内受容体が多数の標的遺伝子を制御し 2、かつRXRのように多くの異なる受容体とパートナーを組んで多様なシグナル経路を統合する役割を担っているためです 3。したがって、このようなハブ分子の機能が破綻すると、単一の臓器やシステムに留まらず、複数の生理系にまたがる複雑な疾患(例えば、PPARγの機能不全が糖尿病、肥満、炎症を伴うメタボリックシンドロームを引き起こすなど 16)が発症する可能性があります。この多系統にわたる影響力は、核内受容体を標的とする治療法の開発において、強力な効果を期待できる一方で、副作用のリスクも慎重に考慮する必要があることを示唆しています。
また、特定の核内受容体、例えばオーファン受容体であるNur77が、がんの種類や細胞が置かれた微小環境によって、ある時は腫瘍の増殖を抑制し、またある時は促進するという、正反対の作用を示すことが報告されています 12。これは、核内受容体の機能が、リガンドの存在だけでなく、細胞内に存在するコファクターの種類や量、他の活性化されているシグナル伝達経路の状態、さらには標的遺伝子のエピジェネティックな状態といった「細胞内コンテクスト」に強く依存していることを示す好例です。Nur77の場合、リガンド非存在下でも活性化されうるため、その機能の方向性は、細胞ごとのタンパク質間相互作用ネットワークやシグナル伝達のバランスによって決定されると考えられます。このようなコンテクスト依存性は、核内受容体研究の複雑さと面白さを示すと同時に、核内受容体を標的とした治療薬を開発する際には、標的とする疾患や組織、さらには病期やサブタイプといった個別の状況を精密に考慮した個別化アプローチが不可欠であることを示唆しています。
4.3. 創薬の標的として:治療戦略における核内受容体の重要性
核内受容体は、その活性が特異的なリガンドによって直接的かつ可逆的に調節されるという性質を持つため、古くから優れた創薬標的として認識され、多くの医薬品開発の対象となってきました 3。
実際に、多くの核内受容体作動薬(アゴニスト)や拮抗薬(アンタゴニスト)が臨床応用されています。例えば、乳がん治療に用いられるタモキシフェンやフルベストラントはERの機能を調節する薬剤です。デキサメタゾンやプレドニゾロンといった合成グルココルチコイドはGR作動薬として、強力な抗炎症作用や免疫抑制作用を期待して、関節リウマチ、気管支喘息、アレルギー疾患、臓器移植後の拒絶反応抑制など、多岐にわたる疾患の治療に不可欠な薬剤となっています。脂質異常症治療薬であるベザフィブラートやフェノフィブラートはPPARα作動薬であり、2型糖尿病治療薬であるピオグリタゾンはPPARγ作動薬です。また、急性前骨髄球性白血病 (APL) の治療に用いられるオールトランスレチノイン酸 (ATRA) はRARαの作動薬として分化誘導療法に貢献しています。
近年では、副作用を軽減し、より高い治療効果を目指して、特定の組織や特定の作用のみを選択的に調節する「選択的受容体モジュレーター (Selective Receptor Modulator; SRM)」の開発が活発に進められています 17。これには、選択的エストロゲン受容体モジュレーター (SERM)、選択的アンドロゲン受容体モジュレーター (SARM)、選択的プロゲステロン受容体モジュレーター (SPRM) などが含まれます。これらの薬剤は、同じ受容体に対して、組織や細胞の種類、あるいは共存するコファクターの違いによって、作動薬として働いたり拮抗薬として働いたりするユニークな性質を持ちます。
さらに、リガンドが未同定であったオーファン受容体の機能が次々と明らかにされるにつれて、これらのオーファン受容体を新たな創薬標的とする研究も急速に進展しています 38。オーファン受容体のリガンドを同定し、その構造活性相関を明らかにすることで、これまで治療法がなかった疾患に対する画期的な新薬が生まれる可能性があります。最近の成功例としては、甲状腺ホルモン受容体β (THR-β) に選択的に作用する作動薬であるResmetiromが、非アルコール性脂肪肝炎 (NASH) の治療薬として米国で承認されたことが挙げられます 13。これは、核内受容体研究が依然として創薬のフロンティアであることを示すものです。
第5章:核内受容体研究の軌跡と未来展望
核内受容体の発見から半世紀以上が経過し、その研究は目覚ましい進展を遂げてきました。ここでは、これまでの主要なブレイクスルーを振り返りつつ、最新の研究トピックスと今後の展望について概説します。
5.1. 発見から半世紀:主要なブレイクスルーと貢献した研究者たち
核内受容体研究の歴史は、いくつかの重要な発見と、それを推進した先駆的な研究者たちの貢献によって彩られています。
- 1980年代中頃 – 主要受容体のクローニングとスーパーファミリー概念の確立: この時期は核内受容体研究の黎明期であり、分子生物学的手法の発展が大きな推進力となりました。Ronald M. Evans博士、Pierre Chambon博士、Bert W. O’Malley博士らの研究グループが中心となり、グルココルチコイド受容体 (GR)、エストロゲン受容体 (ER)、甲状腺ホルモン受容体 (TR) といった主要なステロイドホルモン受容体や甲状腺ホルモン受容体のcDNAクローニングと構造解析に相次いで成功しました 3。これらの研究により、核内受容体が共通のドメイン構造(特にDBDとLBD)を持つこと、そしてこれらが一大遺伝子スーパーファミリーを形成しているという画期的な概念が確立されました。
- オーファン受容体の発見とRXRの中心的役割の解明: 主要な受容体の同定後、相同性検索(ホモロジースクリーニング)によって、リガンドが未知の「オーファン受容体」が次々と発見されました。これは、未知のシグナル伝達経路が存在することを示唆するものでした。特に、David J. Mangelsdorf博士やEvans博士らによるレチノイドX受容体 (RXR) の発見と、RXRが他の多くの核内受容体(TR、VDR、RAR、PPARsなど)とヘテロ二量体を形成する共通のパートナーであることの解明は、核内受容体シグナル伝達ネットワークの理解に大きな進展をもたらしました 3。
- コファクターの同定と機能解析: 核内受容体がどのようにして転写を制御するのかという疑問に対し、O’Malley博士、Michael G. Rosenfeld博士、Christopher K. Glass博士らのグループは、コアクチベーター(SRC-1、CBP/p300など)やコリプレッサー(NCoR、SMRTなど)といった転写共役因子を同定し、その機能解析を進めました。これにより、リガンド依存的なコファクターのリクルートと、それに伴うクロマチン修飾が転写制御の鍵であることが明らかになりました。
- リガンド同定技術(リバースエンドクリノロジー)の発展: オーファン受容体のリガンドを探索するための「リバースエンドクリノロジー」というアプローチが提唱され、多くのオーファン受容体の「デオーファナイゼーション(リガンド同定)」が進みました 3。これにより、脂肪酸がPPARのリガンドであることや、オキシステロールがLXRのリガンドであることなどが発見され、代謝調節における核内受容体の新たな役割が次々と明らかにされました。
これらのブレイクスルーは、核内受容体が単なるホルモンの受け皿ではなく、細胞内外の多様な情報を統合し、遺伝子発現を介して多彩な生命現象を制御する高度な分子システムであることを明らかにしてきました。
5.2. 最新研究トピックス
核内受容体研究は、今日においても活発に進められており、新たな技術や概念の導入によって、その理解はますます深化しています。
- エピジェネティクスと核内受容体: 核内受容体は、コファクターを介してヒストン修飾酵素(HAT、HDAC、ヒストンメチル化酵素、脱メチル化酵素など)やクロマチンリモデリング因子をDNA上の特定領域にリクルートすることで、クロマチン構造をダイナミックに変化させ、遺伝子発現を制御します 29。近年の研究では、DNAメチル化、ヒストンの多様な翻訳後修飾、長鎖ノンコーディングRNA (lncRNA) による制御、さらにはクロマチンループ形成などの3次元ゲノム構造との関連など、核内受容体とエピジェネティック制御機構との複雑な相互作用の解明が進んでいます 29。核内受容体がエピジェネティックな「書き込み役(ライター)」や「消去役(イレイサー)」をどのようにリクルートし、細胞の記憶や運命を制御しているのか、その分子基盤の解明が重要な課題です。
- 構造生物学の進展: X線結晶構造解析に加え、クライオ電子顕微鏡 (Cryo-EM) 技術の飛躍的な進歩により、リガンド、DNA、そして複数のコファクターと結合した状態の核内受容体複合体の高分解能な立体構造解析が可能になってきました 25。これにより、リガンド結合に伴うアロステリックな構造変化、ドメイン間の情報伝達、コファクター選択性のメカニズムなど、核内受容体の動的な振る舞いや機能発現の分子的基盤についての理解が深まっています。
- リガンド非依存的な活性化機構: 従来、核内受容体の活性化は主にリガンド結合に依存すると考えられてきましたが、リン酸化 8、アセチル化、ユビキチン化といった翻訳後修飾や、特定のタンパク質間相互作用によって、リガンドとは独立に、あるいはリガンドと協調して核内受容体の活性が制御されるメカニズムの重要性が認識されるようになってきました。これらのリガンド非依存的な活性化経路は、細胞内の他のシグナル伝達系と核内受容体システムを繋ぐ新たな接点として注目されています。
- オーファン受容体の機能解明とリガンド探索: 未だに生理的リガンドや機能が十分に解明されていないオーファン受容体は数多く残されています 37。ゲノムワイドな機能解析、ケミカルバイオロジー的手法、構造ベースのバーチャルスクリーニングなどを駆使した網羅的なリガンド探索と機能解析が続けられており、新たな生理活性物質の発見や、新規創薬標的としての可能性が追求されています 6。
- 核内受容体と腸内細菌叢: 近年、腸内細菌叢が産生する多様な代謝物が、宿主の核内受容体(特にFXRやPXRなど)のリガンドとして作用し、宿主の代謝、免疫、さらには行動に至るまで影響を与える可能性が示唆されています 74。この「マイクロバイオーム-核内受容体軸」は、健康維持や疾患発症における新たな制御機構として注目されています。
- 組織・細胞特異的な作用機序の解明: 同じ核内受容体であっても、存在する組織や細胞の種類、あるいは発生段階によって、異なる標的遺伝子を制御し、異なる生理作用を示すことが知られています。この組織・細胞特異的な作用発現のメカニズムには、細胞ごとに異なるコファクターの発現パターンや、クロマチンの状態、他の転写因子との相互作用などが関与していると考えられており、その詳細な解明が進行中です。
5.3. 今後の挑戦:個別化医療、未解明な機能の探求
核内受容体研究は、生命科学の根源的な問いに迫るとともに、医学応用への大きな期待を担っています。今後の主要な挑戦としては、以下のような点が挙げられます。
- 個別化医療への応用: 核内受容体遺伝子の個人間の塩基配列の違い(遺伝子多型)や、エピジェネティックな修飾状態の個人差が、薬剤に対する応答性や特定の疾患へのかかりやすさ(感受性)に影響を与えることが分かってきています 14。これらの情報を基に、個人の体質や病態に合わせた最適な治療法を選択する「個別化医療」の実現に向けた研究が期待されます。
- オーファン受容体の完全な機能解明: 多くのオーファン受容体については、依然として生理的なリガンドや生体内での真の機能が完全には解明されていません 14。これらの「最後の謎」を解き明かすことは、新たな生命現象の発見や、画期的な疾患治療法の開発に繋がる可能性があります。
- リガンド非依存的な活性化機構の全体像の把握: リン酸化をはじめとする翻訳後修飾やタンパク質間相互作用によるリガンド非依存的な活性制御メカニズムの全貌を理解し、それらを標的とした新たな治療戦略を開発することが求められます。
- シグナル伝達ネットワークの統合的理解: 個々の核内受容体の機能だけでなく、複数の核内受容体間、あるいは核内受容体と他のシグナル伝達経路との間の複雑なクロストークやフィードバックループを含む、シグナル伝達ネットワーク全体の動態を統合的に理解することが重要です。
- より選択的で副作用の少ない核内受容体標的薬の開発: 既存の核内受容体標的薬には、効果が高い一方で副作用も問題となる場合があります。組織選択性や作用選択性を高め、副作用を最小限に抑えた、より安全で効果的な新規薬剤の開発が継続的な課題です 13。
核内受容体研究は、ゲノム情報、エピゲノム情報、トランスクリプトーム情報、プロテオーム情報、メタボローム情報、そして高精度な構造生物学情報などを統合的に解析し、生命現象をシステムとして理解しようとする「システム生物学」的なアプローチによって、新たな次元へと進化しつつあります。個々の核内受容体は、単独で機能するのではなく、細胞内外の膨大な情報ネットワークの一部として、他の分子と複雑に相互作用しながら機能しています。このシステムレベルでの理解を深めることが、核内受容体の真の役割を明らかにし、疾患のより根本的な治療法を開発するための鍵となるでしょう。
さらに、「リガンド非依存的活性化」という概念の重要性が増していることは、核内受容体が単なるリガンドのセンサーとして機能するだけでなく、細胞内の多様なシグナルを統合し、より柔軟かつ状況に適応した遺伝子制御を行うための、洗練された情報処理ユニットであることを示唆しています。リン酸化などの翻訳後修飾は、しばしば成長因子シグナルや細胞接着シグナルといった他の主要な細胞内シグナル伝達経路の下流で起こります 8。核内受容体がこれらの修飾を受けるということは、リガンドからの情報だけでなく、細胞の増殖状態、周囲の細胞との関係性、ストレス状況といった、より広範な細胞内外の文脈を感知し、それらを統合して最終的な遺伝子発現の出力を決定していることを意味します。このような多入力型の情報処理能力こそが、核内受容体が複雑な生命現象において中心的役割を果たしうる理由であり、この理解は、リガンド結合部位だけでなく、翻訳後修飾酵素や相互作用タンパク質を標的とした、新たな治療戦略の可能性を広げるものです。
おわりに
本記事では、「受容体であり、転写因子でもある核内受容体」というテーマのもと、その基本的な定義から構造、分子メカニズム、多様なファミリー、広範な生理機能と疾患との関わり、そして研究の歴史と最新動向に至るまでを概観してきました。核内受容体は、細胞が外部環境からのシグナル(ホルモンや栄養素など)を感知し、それに応じて遺伝子のスイッチを操作することで、細胞の運命や個体の恒常性を維持するという、生命の根幹に関わる極めて重要な役割を担っています。その「受容体」と「転写因子」という二重の機能は、情報伝達と遺伝子制御という二大生命プロセスを見事に繋ぐ、生命の精巧な仕組みの一端を示しています。
初学者の方々にとっては、核内受容体がステロイドホルモンやビタミンといった身近な物質の作用を分子レベルで理解するための入り口となり、生命の基本的な調節メカニズムの奥深さを感じるきっかけとなったかもしれません。専門家の方々にとっては、既知の知識の再確認とともに、エピジェネティクス、構造生物学、リガンド非依存的活性化、オーファン受容体の機能探索といった最新の研究フロンティアに触れ、未解明領域への挑戦や新たな治療法開発へのインスピレーションを得る機会となったのであれば幸いです。
核内受容体研究は、分子生物学、生化学、内分泌学、薬理学、構造生物学、ゲノム科学、バイオインフォマティクスなど、多岐にわたる学問分野が融合する領域です。今後も、クライオ電子顕微鏡などの革新的な技術の導入や、AIを活用したデータ解析、シングルセル解析、多階層オミクス解析といった学際的なアプローチによって、この分野はさらに飛躍的な発展を遂げることが期待されます。核内受容体の謎を一つ一つ解き明かしていくことは、生命のより深い理解に繋がり、ひいては多くの疾患に苦しむ人々に新たな希望をもたらすものと信じられます。
引用文献
- www.pharm.or.jp, 5月 8, 2025にアクセス、 https://www.pharm.or.jp/words/word00087.html#:~:text=%E8%84%82%E6%BA%B6%E6%80%A7%E3%82%B7%E3%82%B0%E3%83%8A%E3%83%AB%E4%BC%9D%E9%81%94%E5%88%86%E5%AD%90,%E3%81%A6%E6%83%85%E5%A0%B1%E3%82%92%E4%BC%9D%E9%81%94%E3%81%99%E3%82%8B%E3%80%82
- Nuclear receptor – Wikipedia, 5月 8, 2025にアクセス、 https://en.wikipedia.org/wiki/Nuclear_receptor
- Nuclear Receptors, RXR & the Big Bang – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC4029515/
- 核内受容体 – 羊土社, 5月 8, 2025にアクセス、 https://www.yodosha.co.jp/jikkenigaku/keyword/%E6%A0%B8%E5%86%85%E5%8F%97%E5%AE%B9%E4%BD%93/id/735
- www.japanprize.jp, 5月 8, 2025にアクセス、 https://www.japanprize.jp/data/prize/2024/j_2_achievements.pdf
- www.slib.agu.ac.jp, 5月 8, 2025にアクセス、 https://www.slib.agu.ac.jp/gakukaisi/pdf/y12_01.pdf
- Nuclear Hormone Receptors and Gene Expression | Physiological …, 5月 8, 2025にアクセス、 https://journals.physiology.org/doi/full/10.1152/physrev.2001.81.3.1269
- 核内受容体の新規調節機構の発見と病理学への展開 – J-Stage, 5月 8, 2025にアクセス、 https://www.jstage.jst.go.jp/article/fmedj/73/3/73_73.3_65/_html/-char/ja
- The Nuclear Receptor Superfamily: The Second Decade – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6159888/
- The Nuclear Receptor Field: A Historical Overview and Future …, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6108593/
- Recent Insights on the Role of Nuclear Receptors in Alzheimer’s …, 5月 8, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/39940973/
- Controversy and multiple roles of the solitary nucleus receptor Nur77 in disease and physiology – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11904867/
- Leveraging nuclear receptor mediated transcriptional signaling for drug discovery: Historical insights and current advances – PubMed, 5月 8, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/39843136
- Nuclear receptors as pharmacological targets, where are we now …, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11108428/
- Recent Insights on the Role of Nuclear Receptors in Alzheimer’s Disease: Mechanisms and Therapeutic Application – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11818835/
- Nuclear Receptors and Inflammatory Diseases – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3991236/
- Estrogen receptor signaling mechanisms – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6533072/
- Role of estrogen receptors in health and disease – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC9433670/
- The vitamin D receptor: contemporary genomic approaches reveal …, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC5373853/
- Extraskeletal actions of vitamin D – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC5031366/
- Glucocorticoid receptor signaling in health and disease – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3951203/
- The Biology of the Glucocorticoid Receptor: New Signaling …, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC4084612/
- The role of orphan G protein-coupled receptors in pain – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11000026/
- ERRα: a metabolic function for the oldest orphan – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2786240/
- Cryo-EM structure of the CBC-ALYREF complex – eLife, 5月 8, 2025にアクセス、 https://elifesciences.org/articles/91432
- Study of nuclear hormone receptors by an integrative structural biology approach. – ANR, 5月 8, 2025にアクセス、 https://anr.fr/Project-ANR-06-PCVI-0004
- Orphan nuclear receptors: shifting endocrinology into reverse – PubMed, 5月 8, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/10221899/
- Modeling and Deorphanization of Orphan GPCRs – PubMed, 5月 8, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/29188576/
- Epigenetic and epitranscriptomic role of lncRNA in carcinogenesis (Review) – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11900940/
- LncRNAs Ride the Storm of Epigenetic Marks – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11942515/
- Ligand efficacy shifts a nuclear receptor conformational ensemble between transcriptionally active and repressive states – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11871303/
- Allosteric communications between domains of nuclear receptors – PubMed, 5月 8, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/39653158/
- Nuclear receptors and the Warburg effect in cancer – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC4790452/
- Dynamic interplay of nuclear receptors in tumor cell plasticity and drug resistance: Shifting gears in malignant transformations and applications in cancer therapeutics – PubMed, 5月 8, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/38517618/
- Nuclear Receptors in Energy Metabolism – PubMed, 5月 8, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/36107313/
- Nuclear Receptors: Decoding Metabolic Disease – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2254310/
- Comparative Evaluation and Profiling of Chemical Tools for the Nuclear Hormone Receptor Family 2 – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC7617459/
- The Orphan Nuclear Receptors at Their 25th Year Reunion – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3845022/
- A chemogenomics based approach for deorphanization of testicular …, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3783764/
- Epigenetic regulation of nuclear receptors: Implications for endocrine-related diseases and therapeutic strategies – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC12022648/
- Epigenetic Regulation of Chromatin Functions by MicroRNAs and Long Noncoding RNAs and Implications in Human Diseases – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11939841/
- Exploring the nexus of nuclear receptors in hematological …, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC10858172/
- Orphan Nuclear Receptors in Drug Discovery – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2748783/
- Advances in Orphan Nuclear Receptor Pharmacology: A New Era in Drug Discovery – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC7088939/
- Minireview: Conversing With Chromatin: The Language of Nuclear …, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3874455/
- New strategies to enhance the efficiency and precision of drug discovery – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11850385/
- Commentary: The Year in Orphan Nuclear Receptors and Their Coregulators – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3231826/
- The nuclear receptor superfamily: A structural perspective – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6201731/
- Surprising features of nuclear receptor interaction networks revealed by live-cell single-molecule imaging – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11723585/
- Next-Gen Therapeutics: Pioneering Drug Discovery with iPSCs, Genomics, AI, and Clinical Trials in a Dish – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC12011342/
- Nuclear Receptors: Mechanistic Insights into Endocrine Resistance in Prostate and Breast Cancers – MDPI, 5月 8, 2025にアクセス、 https://www.mdpi.com/2813-2564/3/4/22
- Recent Advances in Peptide Drug Discovery: Novel Strategies and Targeted Protein Degradation – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11597556/
- Comparative Evaluation and Profiling of Chemical Tools for the Nuclear Hormone Receptor Family 2 | ACS Pharmacology & Translational Science, 5月 8, 2025にアクセス、 https://pubs.acs.org/doi/10.1021/acsptsci.4c00719
- Epigenetic Regulatory Layers in the 3D Nucleus – PMC – PubMed Central, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC10872226/
- Nuclear receptor drug discovery – PubMed, 5月 8, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/18662801/
- Nucleic acid drugs: recent progress and future perspectives – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11604671/
- Nf2-FAK signaling axis is critical for cranial bone ossification and regeneration – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11903865/
- Recent Advances in Monoclonal Antibody Therapy for Colorectal Cancers – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC7824816/
- lncRNA CARINH regulates expression and function of innate immune transcription factor IRF1 in macrophages | Life Science Alliance, 5月 8, 2025にアクセス、 https://www.life-science-alliance.org/content/8/3/e202403021
- 核内受容体とは何? わかりやすく解説 Weblio辞書, 5月 8, 2025にアクセス、 https://www.weblio.jp/content/%E6%A0%B8%E5%86%85%E5%8F%97%E5%AE%B9%E4%BD%93
- jsre.umin.jp, 5月 8, 2025にアクセス、 https://jsre.umin.jp/10_15kan/15-05.pdf
- 核内ホルモン受容体スーパーファミリー | 東京・ミネルバクリニック, 5月 8, 2025にアクセス、 https://minerva-clinic.or.jp/academic/terminololgyofmedicalgenetics/kagyou/the-nuclear-receptor-superfamily/
- Structure and Function of the Nuclear Receptor Superfamily and …, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6966469/
- Full-length nuclear receptor allosteric regulation – PMC, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC10388211/
- 1月 1, 1970にアクセス、 https://pubmed.ncbi.nlm.nih.gov/39843136/
- 核内受容体 – Wikipedia, 5月 8, 2025にアクセス、 https://ja.wikipedia.org/wiki/%E6%A0%B8%E5%86%85%E5%8F%97%E5%AE%B9%E4%BD%93
- 核内受容体リガンド活性を示す天然化合物, 5月 8, 2025にアクセス、 https://dl.ndl.go.jp/view/prepareDownload?itemId=info%3Andljp%2Fpid%2F9283422&contentNo=1
- ホスホリパーゼD2に依存的なPPARγの活性化阻害にはサイクリックリゾホスファチジン酸が関与する, 5月 8, 2025にアクセス、 http://first.lifesciencedb.jp/archives/864
- pmc.ncbi.nlm.nih.gov, 5月 8, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6159888/#:~:text=Nuclear%20receptors%20can%20be%20grouped,receptors%2C%20and%20monomeric%20orphan%20receptors.
- 研究者詳細 – 松島 綾美, 5月 8, 2025にアクセス、 https://hyoka.ofc.kyushu-u.ac.jp/html/100018265_ja.html
- リアノジン受容体 – 脳科学辞典, 5月 8, 2025にアクセス、 https://bsd.neuroinf.jp/wiki/%E3%83%AA%E3%82%A2%E3%83%8E%E3%82%B8%E3%83%B3%E5%8F%97%E5%AE%B9%E4%BD%93
- 研究者詳細 – 松井 利郎, 5月 8, 2025にアクセス、 https://hyoka.ofc.kyushu-u.ac.jp/html/100022147_ja.html
- NCCN Guidelines Version 4.2019, 5月 8, 2025にアクセス、 https://www2.tri-kobe.org/nccn/guideline/urological/japanese/bladder.pdf
- <健康食品等に関する英文記事情報 統合版>, 5月 8, 2025にアクセス、 https://www.jhnfa.org/t-s18.pdf
- 研究者詳細 – 大谷 直子, 5月 8, 2025にアクセス、 https://kyoiku-kenkyudb.omu.ac.jp/html/100000028_ja.html
- 体細胞の初期化の過程において核内受容体型の転写因子ERRによるメタボリックスイッチによりiPS細胞が誘導される, 5月 8, 2025にアクセス、 https://first.lifesciencedb.jp/archives/10014
- 新規 GPCR 活性化検出法を利用したオーファン受容体のリガンドの同定, 5月 8, 2025にアクセス、 https://www.jbsoc.or.jp/seika/wp-content/uploads/2014/06/85-11-13.pdf
- グレリンの発見から臨床応用まで:古き良き発見の時代に – 生化学, 5月 8, 2025にアクセス、 https://seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2023.950005/data/index.html
- 疾患別個票 – 厚生労働省, 5月 8, 2025にアクセス、 https://www.mhlw.go.jp/content/10905000/000796913.pdf
- 基礎老化研究, 5月 8, 2025にアクセス、 https://www.jsbmg.jp/backnumber/pdf/BG44-3/44-3-ALL.pdf
- バックナンバー – 日本基礎老化学会, 5月 8, 2025にアクセス、 https://www.jsbmg.jp/Henshu_news/Henshu_news.html
- 末梢神経障害 診療ガイドライン, 5月 8, 2025にアクセス、 http://jascc.jp/wp/wp-content/uploads/2024/10/91eafc78cda9babc6d3ca25912c0e28d.pdf
- エピジェネティクス機構による細胞状態とリプログラミング Cellular state and reprogramming are controlled by epigenetic mechanisms, 5月 8, 2025にアクセス、 https://www.dojindo.co.jp/letterj/139/review/01.html
- ライフサイエンス・臨床医学分野(2013年)第2版, 5月 8, 2025にアクセス、 https://www.jst.go.jp/crds/pdf/2013/FR/CRDS-FY2013-FR-03.pdf