I. はじめに:NMDA受容体、脳の「学習スイッチ」
私たちの脳が行う最も驚くべき機能の一つが「学習」と「記憶」です。新しいスキルを習得したり、大切な思い出を何十年も保持したりできるのはなぜでしょうか。この複雑なプロセスの中心に、分子レベルの「主役」が存在します。それが**NMDA受容体(N-methyl-D-aspartate receptor)**です 1。
NMDA受容体は、脳の神経細胞(ニューロン)の表面に存在するタンパク質で、細胞間の情報伝達を担う「受容体」の一種です。特に、学習と記憶の基盤となる脳の「可塑性」(経験に応じて神経回路の結びつきが変化する性質)において、決定的な「学習スイッチ」として機能します 1。このスイッチがなければ、私たちは新しいことを効率的に学ぶことができないと考えられています 2。
しかし、NMDA受容体の物語は、単純な「記憶の分子」という美しい側面だけでは終わりません。この受容体は、「諸刃の剣」としての性質を持っています。その機能が過剰になったり、バランスを失ったりすると、神経細胞を死に至らしめる「興奮毒性」と呼ばれるプロセスを引き起こします 1。この毒性は、アルツハイマー病 1 や脳卒中 3 といった神経変性疾患の主要な原因の一つと考えられています。
さらに、NMDA受容体の機能不全は、統合失調症 7 やうつ病 3 といった精神疾患の病態にも深く関わっています。例えば、もともと麻酔薬として開発された「ケタミン」が、難治性のうつ病に対して数時間で劇的な改善効果を示すことが発見され、治療に革命をもたらしていますが、このケタミンの主要な標的もNMDA受容体です 1。
なぜ、学習に不可欠な分子が、同時に脳細胞を破壊し、精神疾患の原因にもなるのでしょうか?
本レポートは、この根本的な問いに答えるため、NMDA受容体に関する包括的な解説(「一挙解説」)を提供します。まず、神経科学の基礎的な「言葉」を定義し、NMDA受容体のユニークな構造と、その最大の特徴である「偶然の一致を検出する仕組み」を解き明かします。さらに、この受容体がいかにして発見されたかという歴史的経緯と実験手法、そして記憶のメカニズム(LTP)における具体的な役割を詳述します。最後に、アルツハイマー病やうつ病(ケタミン)に関する最新の(2023-2024年)研究動向を分析し、NMDA受容体が持つ「二面性」の謎に迫ります。


II. 神経科学の基礎知識:脳の「言葉」を理解する
NMDA受容体の驚異的な機能を理解するために、まずは脳が情報をやり取りする基本的な「言葉」と「部品」を解説します。これらの概念は、後のセクションを理解するための鍵となります。
神経細胞(ニューロン)
ニューロンは、脳の基本単位であり、情報を処理・伝達するために特化した細胞です 12。数千億個のニューロンが複雑なネットワークを形成しています。ニューロンは情報を「電気信号」(活動電位と呼ばれる)として、軸索という長い「電線」のような部分を伝達させます 12。
シナプス
ニューロン同士は、通常、物理的に直接接続されていません 14。ニューロンとニューロンの間には、「シナプス間隙」と呼ばれる幅わずか20〜40ナノメートル(髪の毛の太さの約3000分の1)の微小な隙間が存在します 15。この接続部分全体を「シナプス」と呼びます 15。
シナプスは、駅のホームと電車の間のような「情報のバトンタッチ場所」です 14。電気信号がシナプスまで到達すると、そこで「神経伝達物質」という化学物質が放出されます 12。この化学物質が隙間を渡り、次のニューロンにある「受容体」に結合することで、情報が化学的に伝達されます 15。
イオンチャネル
イオンチャネルは、細胞を外界と隔てる「細胞膜」に埋め込まれたタンパク質で、特定のイオン(電気を帯びた原子)だけを通すトンネルです 12。
これは、特定の乗客(特定のイオン、例:ナトリウムイオン $Na^{+}$ やカルシウムイオン $Ca^{2+}$)だけが通過できる「厳格な改札口」や「回転式改札口(Turnstile)」に例えられます 18。この改札口は、普段は閉じていますが、特定の条件(例:神経伝達物質が結合する、電圧が変化する)が揃うと、構造を変化させて一時的に開き、イオンを通過させます 18。NMDA受容体も、このイオンチャネルの一種です 19。
脱分極(Depolarization)
ニューロンは、お休みしている時(静止状態)、細胞の内側が外側に対してマイナスの電気を帯びています(約-70ミリボルト) 12。この電気的な「タメ」がある状態を「分極している」と言います。
「脱分極」とは、ニューロンが興奮性の刺激を受け、この内側のマイナスが弱まること(例:-70mVから-50mVへ、0に近づくこと)を指します 21。これは、バネを押し縮めていくプロセスに似ています 12。この脱分極がある一定のライン(閾値)を超えると、ニューロンは「発火」し、活動電位という電気信号を発生させます 22。
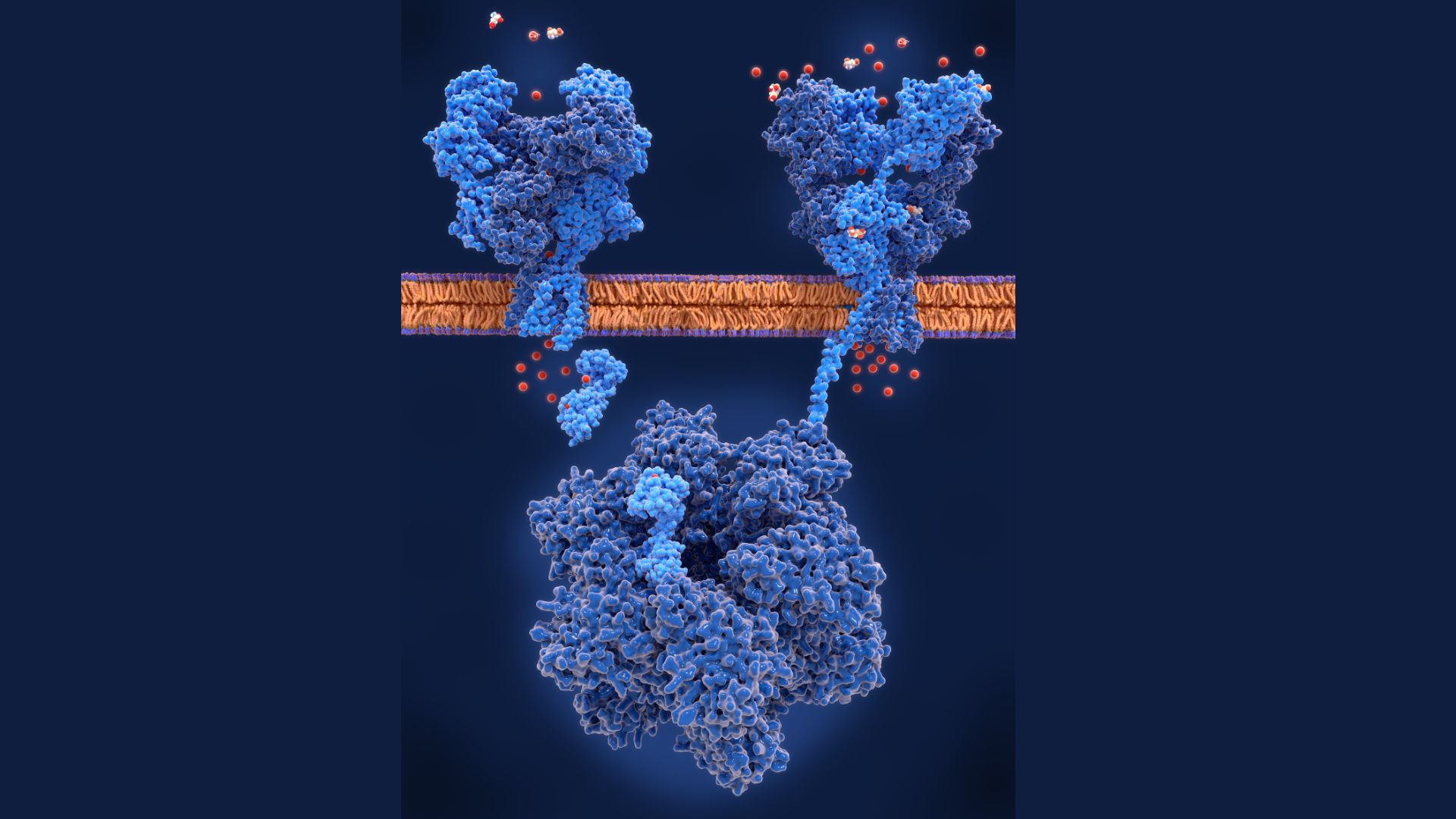
III. NMDA受容体とは何か? そのユニークな構造
NMDA受容体は、前述のイオンチャネルの一種であり、特に「グルタミン酸」という主要な興奮性神経伝達物質によって活性化される受容体(グルタミン酸受容体)のファミリーに属します 1。
4つの部品から成る構造(ヘテロテトラマー)
NMDA受容体は、単一のタンパク質ではなく、通常4つの異なる(または類似の)部品(サブユニット)が組み合わさって、一つの機能的なイオンチャネル(改札口)を形成しています 24。この4量体構造を「ヘテロテトラマー」と呼びます。
サブユニットの種類と「2種類の鍵」
NMDA受容体の構造には、いくつかの種類のサブユニットが関わっています 24。
- GluN1(必須サブユニット): すべてのNMDA受容体に必ず2つ含まれる、必須の部品です 19。
- GluN2(機能決定サブユニット): 残りの2つの部品は、GluN2A、GluN2B、GluN2C、GluN2Dの4種類のうちから選ばれます 24。
- GluN3(調節サブユニット): GluN3A、GluN3Bという部品が組み込まれることもあり、これは受容体の機能を調節します 26。
これらのサブユニットは、「N1/N2/N1/N2」という順番で円形に配置されていると考えられています 28。
NMDA受容体の構造が特にユニークなのは、その活性化に「2種類の鍵」を必要とする点です 24。
- 鍵1:グルタミン酸
- シナプスで放出される主要な神経伝達物質です。これは「GluN2」サブユニットの「鍵穴」に結合します 26。
- 鍵2:グリシン(またはD-セリン)
- グルタミン酸を補助する「共作動薬(コ・アゴニスト)」と呼ばれる物質です。これは「GluN1」サブユニットの「鍵穴」に結合します 26。
他の多くの受容体が1種類の鍵(神経伝達物質)だけで開くのに対し、NMDA受容体は、この2種類の鍵が両方ともそれぞれの鍵穴に差し込まれない限り、チャネルを開く準備ができません 24。これは、NMDA受容体が「シグナル(グルタミン酸)」と「準備状態(グリシン)」という2つの化学的条件の「一致」を検出する、第一の「コインシデンス・ディテクター(偶然の一致の検出装置)」として機能していることを意味します。
多様性が生み出す「個性」
脳の場所や発達段階によって、組み込まれるGluN2サブユニットの種類が異なります 3。例えば、GluN2Bは幼若期に多く、成人ではGluN2Aが増加します 27。このサブユニットの違いが、チャネルが開いている時間やイオンの通しやすさといった「受容体の個性」を決定します。この個性の違いが、脳の各領域が持つ特有の学習能力や、アルツハイマー病(GluN2Bが関与 31)のような特定の疾患の病態に関わっていると考えられています。
IV. 最大の特徴:「偶然の一致」を検出する仕組み(コインシデンス・ディテクター)
NMDA受容体の最も重要かつ驚くべき特徴は、前述の「2つの鍵」だけでは活性化しない点にあります。この受容体は、化学的な条件に加え、電気的な条件が同時に満たされたこと、すなわち「偶然の一致」を検出する精巧な分子装置(コインシデンス・ディテクター)として機能します 30。
NMDA受容体が検出する「2つの出来事」とは、以下の通りです 30:
- 出来事A(化学的シグナル): グルタミン酸とグリシンが受容体に結合すること 24。
- 出来事B(電気的シグナル): その受容体が存在するニューロンが、すでに強く興奮(脱分極)していること 30。
「マグネシウム(Mg2+)のフタ」による制御
なぜこの2つの出来事が同時に必要なのでしょうか。その秘密は、細胞の外に存在する**マグネシウムイオン($Mg^{2+}$)**にあります 24。
1. ニューロンが「お休み」している時(静止状態)
ニューロンが静止している時、細胞の内側はマイナスの電気を帯びています 12。$Mg^{2+}$イオンはプラスの電気を持っているため、細胞の内側のマイナスに引き寄せられ、NMDA受容体のイオンチャネル(通り道)の内部に「栓」または「フタ」のようにはまり込み、物理的にチャネルを塞いでしまいます 24。
この状態を「回転式改札口」のアナロジーで考えてみましょう。「2つの鍵」(グルタミン酸とグリシン)が揃い、改札口のロックは解除されました。しかし、改札口の内部に$Mg^{2+}$という人物が詰まって立ち往生しているため、他の乗客(イオン)は通り抜けることができません。
2. ニューロンが「興奮」した時(脱分極状態)
ニューロンが他のシナプスからの入力などによって強く興奮(脱分極)すると、細胞の内側の電気がマイナスからプラス(あるいは0)に近づきます 22。
すると、チャネル内部に詰まっていたプラスの$Mg^{2+}$イオンは、細胞の内側がプラスになったことで、静電気的な反発力(プラスとプラスは反発し合う)によってチャネルから「押し出されます」 30。
回転式改札口のアナロジーでは、改札口の内側(細胞内)から強い圧力(脱分極)がかかり、詰まっていた$Mg^{2+}$が外に押し出されるイメージです。
決定的なシグナル:「カルシウム(Ca2+)」の流入
この2つの条件—「(1) 2つの鍵が揃う」こと、かつ「(2) 脱分極によって$Mg^{2+}$のフタが外れる」こと—が同時に満たされた時、初めてNMDA受容体のチャネルは完全に開通します。
そして、ナトリウムイオン($Na^{+}$)と共に、最も重要なシグナル伝達物質である**カルシウムイオン($Ca^{2+}$)**が、細胞の内側へ大量に流れ込みます 19。
この$Ca^{2+}$の流入こそが、ニューロンに対して「今、2つの出来事が同時に起こったぞ!」と伝える決定的なシグナルとなり、後のセクションで解説する「記憶(LTP)」のプロセスを開始させる引き金となります。
「連合学習」を可能にする分子の論理ゲート
このNMDA受容体の仕組みは、電子工学における「ANDゲート(論理積)」そのものです。つまり、「入力A(グルタミン酸)」かつ「入力B(脱分極)」が揃った時のみ、「出力($Ca^{2+}$流入)」を生み出します。
この機能こそが、脳が「関連性」を学ぶための物理的な基盤です。例えば、「パブロフの犬」の実験では、「ベルの音(入力A)」と「エサ(入力B)」が同時に提示され続けることで、犬は2つを関連付けて学習します。これと同様に、脳内であるニューロンA(ベルの音)からの信号と、ニューロンB(エサ)からの信号が、特定のニューロンC上で「ほぼ同時に」到着し、ニューロンCを脱分極させた(入力B)タイミングでグルタミン酸が放出された(入力A)場合、NMDA受容体が作動します。その結果、「AとBは関連している」という情報が$Ca^{2+}$流入という形で刻まれ、そのシナプスが強化されるのです。
V. 発見の歴史:NMDA受容体はいかにして見出されたか
NMDA受容体が脳の「記憶の分子」として主役の座に躍り出た背景には、異なる分野の発見が奇跡的に組み合わさった、ドラマチックな科学の進展がありました。
1. 始まりは「道具」から:ジェフ・ワトキンス(Jeff Watkins)の貢献 (1960年代〜)
NMDA受容体の物語は、イギリスの化学者ジェフ・ワトキンスの地道な研究から始まります 34。当時、グルタミン酸が脳の神経伝達物質であるか否かは、まだ議論の最中でした。ワトキンスは、グルタミン酸やそれに似た構造を持つ化学物質を何十種類も合成し、その作用を一つ一つ調べました 34。
その合成物の一つが、自然界には存在しない人工物質「N-メチル-D-アスパラギン酸(NMDA)」でした 24。ワトキンスは、このNMDAという「鍵」にだけ特異的に反応する「鍵穴」(受容体)が存在することを発見し、それを「NMDA受容体」と名付けました 34。
彼の最大の功績は、受容体を分類したこと(AMPA受容体、カイニン酸受容体、NMDA受容体) 34 だけでなく、その働きを特異的にブロックする「拮抗薬(アンタゴニスト)」という「道具」を開発したことです 34。その代表格が「APV」(またはAP5、2-アミノ-5-ホスホノペンタン酸)と呼ばれる物質です 34。このAPVが、NMDA受容体と記憶を結びつける決定的な証拠となりました。
2. 記憶とのリンク:CollingridgeらのLTP遮断実験 (1983年)
1980年代初頭、科学者たちは記憶の細胞メカニズムとして「長期増強(LTP: Long-Term Potentiation)」という現象に注目していました 40。これは、シナプスを強力に(高頻度で)刺激すると、そのシナプスの伝達効率が数時間から数日にわたって永続的に強まる現象で、記憶の「書き込み」プロセスそのものだと考えられていました 40。
1983年、Graham Collingridgeらの研究グループは、記憶の中枢である「海馬」の脳切片(スライス)を用い、ワトキンスが開発した「APV」を投与するという画期的な実験を行いました 38。
その結果は衝撃的でした。APVを投与すると、LTPが完全にブロックされたのです 42。つまり、高頻度刺激を与えても、シナプスは全く強化されませんでした。一方で、APVはLTPを誘発しない通常の神経伝達には、ほとんど影響を与えませんでした 38。
この実験が意味することは明確でした。「NMDA受容体の活性化こそが、LTP(=記憶形成)を引き起こす『引き金(トリガー)』である」 38。NMDA受容体は、通常の伝達には関与しないが、学習という「特別なイベント」の時だけ作動するスイッチであることが示されたのです。
3. メカニズムの解明:Mg2+ブロックの発見 (1984年)
Collingridgeの発見の翌年、科学者たちの最大の疑問は「なぜNMDA受容体は、通常の伝達ではなく、LTPという特別な時だけ作動するのか?」でした。その答えは、1984年に2つの研究グループによって、ほぼ同時に、そして驚くほど詳細に解明されました。
- グループ1: Nowak, Ascherらの研究 43
- グループ2: Mayer, Westbrookらの研究 35
彼らは「パッチクランプ法」という、当時最新鋭の生物物理学的な実験技術を用いました。
実験手法の解説:パッチクランプと「J字型 I-Vカーブ」
パッチクランプ法とは?
パッチクランプ法は、先端が非常に細いガラス製の電極をニューロンの細胞膜に押し当て、膜に密着させる技術です 33。これにより、そのパッチ(当て布)の部分に含まれる、たった1個のイオンチャネル(回転式改札口)を流れる、ピコアンペア(1兆分の1アンペア)レベルの微小な電流を直接測定することができます 46。
彼らの発見
Nowak, Mayerらのグループは、この技術を使い、NMDA受容体のチャネルを通る電流を測定しました 45。
- 彼らはまず、細胞の外液に、体液と同じ濃度の**マグネシウム($Mg^{2+}$)**を加えて実験しました。すると、ニューロンが静止状態(内側がマイナス)の時は、グルタミン酸を加えてもNMDA受容体は全く電流を通しませんでした 45。
- 次に、彼らは決定的な実験を行いました。細胞の外液から**$Mg^{2+}$だけを人為的に取り除いた**のです。すると、ニューロンが静止状態(内側がマイナス)のままでも、NMDA受容体はグルタミン酸に応答して大きな電流を流しました 45。
この結果は、Collingridgeが探していた「LTPの時だけ作動する仕組み」の答えでした。犯人は$Mg^{2+}$だったのです 18。
特異な「J字型 I-Vカーブ」
この$Mg^{2+}$ブロックの証拠は、「I-Vカーブ(電流-電圧関係)」というグラフに明確に現れます 24。これは、パッチクランプ法でニューロンの膜電位(電圧, V)を人工的に様々に変化させながら、その時にチャネルを流れる電流(I)をプロットしたものです 52。
- AMPA受容体のような通常のチャネルは、電圧と電流が比例する「直線」のグラフになります。
- しかし、NMDA受容体は、$Mg^{2+}$が存在すると、特徴的な「J字型」(またはN字型)の非線形なカーブを描きます 24。
このJ字型カーブは、以下のように説明できます 52:
(1) 膜電位がマイナス(静止時)の領域では、$Mg^{2+}$が「フタ」をしているため、電圧をかけても電流が流れません(グラフは0アンペアのまま)。(2) 膜電位が0に近づき(脱分極)、ある点(例:-30mV)を超えると、$Mg^{2+}$の「フタ」が外れます 33。 (3) すると、それまで堰き止められていたイオンが一気に流れ込み、電流が「急激に」立ち上がります 51。この急激な立ち上がりが、グラフ上で「J」の字の形を作るのです。
この1983年から1984年にかけての一連の発見—(1) 化学(ワトキンスによるAPVの開発)、(2) 生理学(コリングリッジによるLTP遮断)、(3) 生物物理学(ノワック/メイヤーによる$Mg^{2+}$ブロックの証明)—は、異なる分野の知見が奇跡的に収束し、「記憶」という脳の最も深遠な機能の分子的実体を明らかにした、神経科学における金字塔となりました。
VI. NMDA受容体と「記憶」:シナプス可塑性の分子メカニズム
NMDA受容体が「コインシデンス・ディテクター」として作動し、$Ca^{2+}$を細胞内に流入させることが、どのようにして「記憶」という永続的な変化につながるのでしょうか。その答えが「シナプス可塑性」です 1。
記憶とは、特定のニューロン間の接続(シナプス)の伝達効率が、経験によって長期間にわたって変化することです 1。NMDA受容体は、このシナプス強度を「強める(LTP)」か「弱める(LTD)」かを決定する、中心的な役割を担っています。
LTP(長期増強):記憶の「書き込み」プロセス
LTPは、シナプス結合を永続的に強化するプロセスであり、記憶の「書き込み」または「保存」の基本的な仕組みであると考えられています 40。NMDA受容体は、このLTPの「誘導(Induction)」の引き金を引きます 41。
その分子メカニズムは、以下のステップで進行します 41:
ステップ1:誘導(トリガー)
ニューロンが高頻度で活動(例:テタヌス刺激)すると、シナプスは強く脱分極します 41。これにより、NMDA受容体の$Mg^{2+}$ブロックが解除され、チャネルが開通。決定的なメッセンジャーである**$Ca^{2+}$が細胞内に大量に流入**します 41。
ステップ2:シグナル伝達(初期)
流入した$Ca^{2+}$は、細胞内で「CaMKII(カムカイニ)」をはじめとする様々な「リン酸化酵素」(タンパク質に”印”を付ける酵素)を活性化します 41。
ステップ3:発現(アンテナの増設)
活性化されたCaMKIIは、シナプス後部の細胞膜(情報を受け取る側)に対して「アンテナを増やせ」という指令を出します。具体的には、普段は細胞内部に「予備」として待機していたAMPA受容体を、細胞の表面(シナプス後膜)に移動させ、設置(挿入)させます 33。
(AMPA受容体は、NMDA受容体と同じくグルタミン酸で開くチャネルですが、$Mg^{2+}$ブロックを持たず、主に$Na^{+}$を通すため、通常の高速な神経伝達を担っています 33。)
ステップ4:結果(初期の強化)
シナプス表面のAMPA受容体(アンテナ)の数が増えるため、次に同じ量のグルタミン酸が放出されても、より多くのアンテナが信号をキャッチし、より大きな応答(脱分極)を引き起こすようになります。これがLTPの初期段階(数時間持続)です。
ステップ5:維持(後期の強化と構造変化)
より永続的な記憶(数日から一生)のためには、シナプス自体を物理的に作り変える必要があります。$Ca^{2+}$シグナルの一部は、細胞の「核」(細胞の設計図であるDNAが保管されている場所)にまで到達します 30。そこで、新しいタンパク質を合成するための遺伝子のスイッチを入れます 41。
これらの新しいタンパク質が、シナプスを物理的に大きく、強固な構造(例:樹状突起スパインの肥大)に作り変え、LTPが長期的に維持されます 41。
LTD(長期抑圧):記憶の「調整」と「消去」
驚くべきことに、NMDA受容体はシナプスを強めるLTPだけでなく、逆に弱める「長期抑圧(LTD: Long-Term Depression)」の誘導にも関与しています 3。
「Ca2+のボリューム・ダイヤル」という巧妙な仕組み
なぜ同じNMDA受容体が、LTP(強化)とLTD(弱化)という正反対の現象を引き起こせるのでしょうか。この運命を決定しているのは、NMDA受容体を介して流入する「$Ca^{2+}$の流入パターンと量」であると考えられています。
- LTP(強化): 高頻度の強い刺激によって引き起こされます 40。これは、NMDA受容体を強く、持続的に活性化させ、「大量かつ急速な$Ca^{2+}$流入」を引き起こします 41。この「大音量」の$Ca^{2+}$シグナルが、LTPの酵素(例:CaMKII)を活性化します。
- LTD(弱化): 低頻度の弱い刺激によって引き起こされます 30。これは、NMDA受容体を弱く、断続的に活性化させ、「少量かつ緩やかな$Ca^{2+}$流入」を引き起こします。この「小音量」の$Ca^{2+}$シグナルが、LTDの酵素(例:ホスファターゼ、タンパク質から”印”を外す酵素)を活性化します。
つまり、NMDA受容体は単なる「ON/OFFスイッチ」ではなく、流入する$Ca^{2+}$の量を調節する「ボリューム・ダイヤル」のように機能し、その「音量」の違いによって、細胞は「強化する」か「弱化する」かを判断しているのです。
VII. 関連する薬剤:NMDA受容体をブロックする方法(拮抗薬)
NMDA受容体の複雑な機能を研究したり、その機能不全が関わる疾患を治療したりするために、その働きを妨げる「拮抗薬(アンタゴニスト)」が数多く開発されてきました。
これらの薬剤は、NMDA受容体を「どのように邪魔するか」によって、いくつかのタイプに分類されます 57。この違いを理解することは、アルツハイマー病治療薬「メマンチン」や抗うつ薬「ケタミン」の作用を理解する上で極めて重要です。
タイプ1:競合的拮抗薬 (Competitive Antagonists)
- 代表的な薬剤: APV (AP5) 38, CGP 37849 58
- 作用機序: グルタミン酸が結合する「鍵穴(グルタミン酸結合部位)」を奪い合います 57。グルタミン酸よりも先に鍵穴に結合することで、本来の鍵(グルタミン酸)が結合できなくなり、受容体は活性化しません。
- アナロジー: 「鍵穴にガムを詰める」。本来の鍵が入る場所を物理的に塞いでしまいます。
タイプ2:非競合的(アンコンペティティブ)チャネルブロッカー (Uncompetitive Channel Blockers)
- 代表的な薬剤: ケタミン (Ketamine) 1, MK-801 (Dizocilpine) 60, メマンチン (Memantine) 24, フェンサイクリジン (PCP) 1
- 作用機序: 鍵穴(グルタミン酸やグリシンの結合部位)には一切触れません。そうではなく、受容体が一度活性化してチャネル(イオンの通り道)が開いた後に、その通り道の内部に物理的に入り込み、チャネルを内側から「栓」をします 57。
- アナロジー: 「開いた回転式改札口の内部に入り込み、立ち往生する」。鍵は正常に作動し、改札口は開いたにもかかわらず、内部で詰まることで後続のイオン(乗客)の流れを物理的に止めます。
タイプ3:グリシン部位拮抗薬 (Glycine Antagonists)
- 代表的な薬剤: L701,324 63, HA-966 34
- 作用機序: もう一つの「鍵穴」であるグリシン結合部位に結合し、活性化を妨げます 57。
この分類を理解しやすくするために、実験で使われるAPVと、臨床で使われるケタミンの違いを表にまとめます。
表1:NMDA受容体拮抗薬の比較:APVとケタミンの違い
| 特徴 | 競合的拮抗薬 (Competitive) | 非競合的(アンコンペティティブ)チャネルブロッカー (Uncompetitive) |
| 代表的な薬剤 | APV (AP5) 38 | ケタミン (Ketamine), メマンチン 59 |
| 結合する場所 | グルタミン酸の結合部位(鍵穴) 57 | イオンチャネルの内部(通り道) 57 |
| 作用の前提条件 | いつでも結合できる | チャネルが開いている必要がある 58 |
| アナロジー | 「鍵穴にガムを詰める」 | 「開いた改札口やトンネルの内部で詰まる」 |
「使用依存性(Use-Dependence)」という重要な特性
タイプ2(ケタミンやメマンチン)の作用機序は、「使用依存性(Use-Dependence)」 60 という非常に重要な薬理学的特性を生み出します。
これは、これらの薬剤がチャネル内部に詰まるためには、まずチャネルが開いている(=使用されている)必要がある 58 ことを意味します。
この特性は、疾患治療において決定的に重要です。
例えば、アルツハイマー病や脳卒中では、一部のニューロンがグルタミン酸を過剰に放出し続け、NMDA受容体が「過剰に興奮」した状態(興奮毒性)にあると考えられています 4。
- 競合的拮抗薬(APVなど)は、鍵穴を無差別に塞ぐため、病的なシナプスも健康なシナプスも区別なくブロックしてしまい、記憶などの正常な脳機能まで停止させてしまいます。
- 一方、非競合的ブロッカー(メマンチンなど)は、「使用依存性」があるため、頻繁に開いている「過剰に興奮した病的なチャネル」を優先的にブロックし、たまにしか開かない「正常な記憶を担うチャネル」にはあまり影響を与えません 32。
この巧妙なメカニズムこそが、メマンチンがアルツハイマー病患者の記憶機能を完全に破壊することなく、病的な興奮だけを抑えることができる理由であると考えられています。
VIII. 最新の研究動向:疾患と治療の最前線(2023-2024年)
NMDA受容体研究は、2023年から2024年にかけても活発に進められており、特に「なぜNMDA受容体は学習と疾患という二つの顔を持つのか?」という本レポートの冒頭の問いに対する、精緻な答えが明らかになってきました。
最新の知見(1):「局在仮説」— 2つの顔を持つNMDA受容体
NMDA受容体研究における現代の最も重要なパラダイムシフトは、「局在仮説(Localization Hypothesis)」です 24。これは、NMDA受容体の機能が、「細胞のどこに存在するか」によって、生存と死という全く逆の役割を果たすという理論です 24。
「シナプスNMDA受容体 (sNMDAR)」 (善玉)
- 場所: シナプスの内側、情報を受け取る「シナプス後肥厚部(PSD)」という構造に固定されています 31。
- 役割: これが「学習と記憶のスイッチ」です。活性化すると$Ca^{2+}$が流入し、LTPを誘導します 31。さらに重要なことに、sNMDARの活性化は、CREBと呼ばれる転写因子を活性化させ、抗酸化防御や抗アポトーシス(細胞死の抑制)遺伝子のスイッチを入れ、神経を保護するシグナルをONにします 24。
「シナプス外NMDA受容体 (eNMDAR)」 (悪玉)
- 場所: シナプスの外側、例えば樹状突起の軸や細胞本体の膜など、シナプスから離れた場所に存在します 31。
- 役割: これが「細胞死のスイッチ」です。何らかの原因(例:脳卒中や疾患)でグルタミン酸がシナプス外に漏れ出し、eNMDARが活性化すると、LTD(忘却)を誘導します 19。さらに、sNMDARとは異なるシグナル伝達(例:CREBのシャットオフ、nNOSの活性化)を引き起こし、ミトコンドリアの機能不全や酸化ストレスを増大させ、細胞死(興奮毒性)を積極的に促進します 24。
この「善玉」と「悪玉」の二面性こそが、NMDA受容体パラドックスの答えです。
表2:シナプス受容体 vs シナプス外受容体:局在仮説
| 特徴 | シナプスNMDAR (sNMDAR) | シナプス外NMDAR (eNMDAR) |
| 場所 | シナプス内部 (PSD) 31 | シナプスの外側 31 |
| 主な役割 | 神経保護 (Neuroprotection), LTP(記憶) 31 | 細胞死 (Excitotoxicity), LTD(忘却) 31 |
| 下流シグナル | CREB活性化 (生存シグナル) 31 | CREBシャットオフ (細胞死シグナル) 19 |
| 疾患との関連 | 機能低下が認知障害に関与 | 過剰活動が神経変性(AD)に関与 31 |
最新の知見(2):アルツハイマー病(AD)との関連
「局在仮説」は、アルツハイマー病の病態を説明する上で極めて重要です。ADでは、脳内にアミロイドβ(Aβ)オリゴマーという毒性タンパク質が蓄積します 62。
最新の研究では、このAβオリゴマーが、NMDA受容体の「局在バランス」を破壊することが示唆されています 4。Aβは、「善玉」であるsNMDARをシナプスから引き剥がし、除去してしまう一方で、「悪玉」であるeNMDAR(特にGluN2Bサブユニットを含むもの)を活性化させ、シナプス外へ移動させると考えられています 4。
その結果、神経保護シグナル(sNMDAR)が失われ、細胞死シグナル(eNMDAR)が優位となり、神経細胞が死に至る(神経変性)と考えられます 4。
最新の知見(3):ケタミンの迅速な抗うつ効果(2024年の知見)
ケタミンが難治性うつ病に劇的な効果を示すことは知られていましたが、そのメカニズムは長年の謎でした。うつ病はシナプスの機能低下や喪失が関わるとされるのに、なぜシナプス機能をブロックするケタミンが効くのでしょうか?
2024年の最新のレビュー 10 によると、ケタミンの作用は、NMDARの単純な遮断ではなく、以下のような逆説的(パラドキシカル)な連鎖反応であることがわかってきました。
- NMDAR遮断: ケタミンがNMDARをブロックします。この時、特に抑制性(GABA作動性)介在ニューロン上のNMDARを主にブロックすると考えられています 9。
- 抑制の解除(脱抑制): 抑制性ニューロンが黙らされた結果、興奮性ニューロンの「ブレーキ」が外れ、脳内の**グルタミン酸放出が逆に急増(サージ)**します 9。
- AMPA受容体の活性化: この急増したグルタミン酸が、NMDA受容体ではなく、隣にあるAMPA受容体($Mg^{2+}$ブロックを持たない高速チャネル)を強力に活性化します 9。
- 「シナプス成長」シグナルの起動: AMPA受容体の強力な活性化が引き金となり、BDNF(脳由来神経栄養因子)やmTORといった、細胞に「シナプスを新しく作れ・成長させろ」と指令するシグナル伝達経路が活性化します 9。
- シナプス新生: 最終的に、うつ病で失われていたシナプスが**再構築(シナプス新生)**され、神経回路が修復されることで、迅速な抗うつ効果が発揮されると考えられています 9。
つまり、ケタミンはNMDA受容体系を「一時的に操作するレバー」として利用し、本当に起動したかったのはAMPA受容体とBDNF/mTORという「シナプス成長システム」だったのです。
さらに2024年の研究では、ケタミンの作用はNMDAR系だけでなく、オピオイド受容体も関与している可能性が示唆されています 11。ケタミンの効果は、単一の標的ではなく、複数のシステムが関わる「多剤薬理学的」なものである可能性が高まっています。
最新の知見(4):統合失調症とNMDAR機能低下仮説
アルツハイマー病やうつ病とは対照的に、統合失調症(特に思考のまとまりのなさや意欲低下といった認知機能障害・陰性症状)は、NMDA受容体の「機能低下(Hypofunction)」が原因であるとする仮説が有力です 7。
この仮説の強力な裏付けとなっているのが、ケタミンやPCPといったNMDA受容体拮抗薬(ブロッカー)を健常者に投与すると、統合失調症そっくりの幻覚や認知障害を引き起こすという事実です 1。
「局在仮説」に照らし合わせると、統合失調症は「善玉」であるsNMDARの機能が低下した状態であり、アルツハイマー病は「悪玉」であるeNMDARが過剰に活動した状態である、という対照的な病態が浮かび上がってきます。
IX. 結論:NMDA受容体 — 脳を理解する鍵
本レポートでは、NMDA受容体について、その基礎的な構造から、記憶における役割、発見の歴史、そして疾患との関連における最新の研究動向までを包括的に解説しました。
NMDA受容体は、単なるイオンチャネル(回転式改札口)ではありません。それは、(1) 2種類の鍵(グルタミン酸とグリシン) 24 と、(2) 1つの物理的な栓($Mg^{2+}$) 24 を用い、(3) 「化学的シグナル(神経伝達物質の結合)」と「電気的シグナル(ニューロンの興奮)」という、2つの出来事の「偶然の一致」を検出する、驚くほど精巧な「分子コンピューター(ANDゲート)」です 30。
この「コインシデンス・ディテクター」機能こそが、2つの出来事を関連付けて学ぶ「連合学習」の物理的な基盤であり、$Ca^{2+}$というシグナルを細胞内に流入させることでLTP(長期増強)を引き起こす、まさしく「記憶のスイッチ」です 1。
そして、この受容体研究の最前線(2023-2024年)は、その機能が「場所(Location)」によって決定的に異なるという「局在仮説」に集約されます 66。
- シナプス内部にある「善玉」のsNMDARは、記憶(LTP)と神経細胞の生存を司ります 31。
- シナプス外側にある「悪玉」のeNMDARは、忘却(LTD)と神経の細胞死(興奮毒性)を司ります 31。
この「善玉」と「悪玉」の二面性の発見は、なぜNMDA受容体が学習とアルツハイマー病という正反対の現象に関わるのかという長年のパラドックスを解明しました 31。
この理解は、ケタミンのような既存薬の複雑な作用(NMDARを操作してAMPA/BDNF系を起動する)11 を解き明かすだけでなく、アルツハイマー病や統合失調症といった難病に対する未来の治療戦略を照らしています。もはや、NMDA受容体を十把一絡げにブロックしたり、活性化したりする時代は終わりつつあります。今後の治療薬開発は、「悪玉」のeNMDARだけを選択的にブロックする薬剤(アルツハイマー病向け) 67 や、「善玉」のsNMDARの機能だけを特異的に高める薬剤(統合失調症向け) 8 といった、より高精度な制御を目指すことになるでしょう。
NMDA受容体の理解は、脳という最も複雑なシステムを理解し、その病を治療するための、今もなお最も重要な「鍵」であり続けています。
引用文献
- Physiology, NMDA Receptor – StatPearls – NCBI Bookshelf – NIH, 11月 18, 2025にアクセス、 https://www.ncbi.nlm.nih.gov/books/NBK519495/
- Involvement of the NMDA System in Learning and Memory – Animal Models of Cognitive Impairment – NCBI, 11月 18, 2025にアクセス、 https://www.ncbi.nlm.nih.gov/books/NBK2532/
- NMDA Receptors: Distribution, Role, and Insights into Neuropsychiatric Disorders – MDPI, 11月 18, 2025にアクセス、 https://www.mdpi.com/1424-8247/17/10/1265
- The Dual Role of Glutamatergic Neurotransmission in Alzheimer’s Disease: From Pathophysiology to Pharmacotherapy – MDPI, 11月 18, 2025にアクセス、 https://www.mdpi.com/1422-0067/21/20/7452
- Impact of DL-3-n-Butylphthalide on Progression in Alzheimer’s Disease: A Retrospective Cohort Analysis – Dove Medical Press, 11月 18, 2025にアクセス、 https://www.dovepress.com/impact-of-dl-3-n-butylphthalide-on-progression-in-alzheimers-disease-a-peer-reviewed-fulltext-article-NDT
- Future Perspectives of NMDAR in CNS Disorders – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11857888/
- NMDA Receptor and Schizophrenia: A Brief History – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3446237/
- Advances in the Treatment of Cognitive Impairment in Schizophrenia: Targeting NMDA Receptor Pathways – PubMed, 11月 18, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/39408997/
- A Review of the Mechanism of Antagonism of N-methyl-D-aspartate Receptor by Ketamine in Treatment-resistant Depression – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6051558/
- Ketamine and rapid antidepressant action: new treatments and novel synaptic signaling mechanisms – PubMed, 11月 18, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/37488280/
- Beyond NMDA Receptors: A Narrative Review of Ketamine’s Rapid …, 11月 18, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/39769420/
- Action potentials and synapses – Queensland Brain Institute, 11月 18, 2025にアクセス、 https://qbi.uq.edu.au/brain-basics/brain/brain-physiology/action-potentials-and-synapses
- How Neurons Communicate – BrainFacts, 11月 18, 2025にアクセス、 https://www.brainfacts.org/brain-anatomy-and-function/cells-and-circuits/2019/how-neurons-communicate-08232019
- 2-Minute Neuroscience: Synaptic Transmission – YouTube, 11月 18, 2025にアクセス、 https://www.youtube.com/watch?v=WhowH0kb7n0
- Synapse – Wikipedia, 11月 18, 2025にアクセス、 https://en.wikipedia.org/wiki/Synapse
- Neurotransmission: The Synapse – Dana Foundation, 11月 18, 2025にアクセス、 https://dana.org/resources/neurotransmission-the-synapse/
- Ion Channels and the Electrical Properties of Membranes – Molecular Biology of the Cell – NCBI Bookshelf, 11月 18, 2025にアクセス、 https://www.ncbi.nlm.nih.gov/books/NBK26910/
- membrane ion channel is like a turnstile – Science-Education …, 11月 18, 2025にアクセス、 https://science-education-research.com/reference/science-comparisons/membrane-ion-channel-is-like-a-turnstile/
- NMDA Receptor Function During Senescence: Implication on Cognitive Performance, 11月 18, 2025にアクセス、 https://www.frontiersin.org/journals/neuroscience/articles/10.3389/fnins.2015.00473/full
- NMDA Receptors and Metaplasticity: Mechanisms and Possible Roles in Neuropsychiatric Disorders – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3288588/
- 2-Minute Neuroscience: Action Potential – YouTube, 11月 18, 2025にアクセス、 https://www.youtube.com/watch?v=W2hHt_PXe5o
- Depolarization, hyperpolarization & neuron action potentials (article) – Khan Academy, 11月 18, 2025にアクセス、 https://www.khanacademy.org/science/biology/human-biology/neuron-nervous-system/a/depolarization-hyperpolarization-and-action-potentials
- Neuroscience For Kids – action potential, 11月 18, 2025にアクセス、 http://faculty.washington.edu/chudler/ap.html
- NMDA receptor – Wikipedia, 11月 18, 2025にアクセス、 https://en.wikipedia.org/wiki/NMDA_receptor
- The Extracellular Domains of GluN Subunits Play an Essential Role in Processing NMDA Receptors in the ER – Frontiers, 11月 18, 2025にアクセス、 https://www.frontiersin.org/journals/neuroscience/articles/10.3389/fnins.2021.603715/full
- 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC12005412/#:~:text=NMDARs%20are%20composed%20of%20seven,and%20GluN3B)%20also%20bind%20glycine.
- The GluN3-containing NMDA receptors – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC12005412/
- Arrangement of subunits in functional NMDA receptors – PubMed – NIH, 11月 18, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/21813689/
- Arrangement of Subunits in Functional NMDA Receptors – Journal of Neuroscience, 11月 18, 2025にアクセス、 https://www.jneurosci.org/content/31/31/11295
- Activation Mechanisms of the NMDA Receptor – Biology of the …, 11月 18, 2025にアクセス、 https://www.ncbi.nlm.nih.gov/books/NBK5274/
- NMDARs in Alzheimer’s Disease: Between Synaptic and …, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11431980/
- Amyloid β, Glutamate, Excitotoxicity in Alzheimer’s Disease: Are We on the Right Track?, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6493397/
- Whole-cell patch clamp electrophysiology to study ionotropic …, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6642821/
- Jeff Watkins – A chemist with enormous impact upon neurobiology, 11月 18, 2025にアクセス、 https://hellobio.com/blog/jeff-watkins-a-chemist-with-enormous-impact-upon-neurobiology.html
- Pharmacology of NMDA Receptors – NCBI, 11月 18, 2025にアクセス、 https://www.ncbi.nlm.nih.gov/books/NBK5282/
- The glutamate story – PubMed, 11月 18, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/16402093/
- 11月 18, 2025にアクセス、 https://en.wikipedia.org/wiki/NMDA_receptor#:~:text=11%20References-,History,in%20several%20central%20synaptic%20pathways.
- NMDA receptors and memory encoding – PubMed, 11月 18, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/23628345/
- The 1980s: d-AP5, LTP and a Decade of NMDA Receptor Discoveries – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6420420/
- Long-term potentiation – Wikipedia, 11月 18, 2025にアクセス、 https://en.wikipedia.org/wiki/Long-term_potentiation
- NMDA Receptor-Dependent Long-Term Potentiation and Long …, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3367554/
- Long-term potentiation and the role of N-methyl-d-aspartate …, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC4563944/
- Nowak, L. P., Bregestovski, P., Ascher, P., Herbert, A. & Prochiantz, A. Magnesium gates glutamate-activated channels in mouse central neurones. Nature 307, 462-465 – ResearchGate, 11月 18, 2025にアクセス、 https://www.researchgate.net/publication/16876291_Nowak_L_P_Bregestovski_P_Ascher_P_Herbert_A_Prochiantz_A_Magnesium_gates_glutamate-activated_channels_in_mouse_central_neurones_Nature_307_462-465
- Permeant ion regulation of N-methyl-d-aspartate receptor channel block by Mg2+ | PNAS, 11月 18, 2025にアクセス、 https://www.pnas.org/doi/abs/10.1073/pnas.96.25.14571
- Voltage-dependent block by Mg2+ of NMDA responses in spinal cord neurones – PubMed, 11月 18, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/6325946/
- Kinetics of Mg2+ unblock of NMDA receptors: implications for spike-timing dependent synaptic plasticity – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC1664940/
- Early biophysics of the NMDA receptor channel – PMC, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2768012/
- Magnesium acts as a second messenger in the regulation of NMDA receptor mediated CREB signaling in neurons – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC8202957/
- Synaptic NMDA receptor activity at resting membrane potentials – Frontiers, 11月 18, 2025にアクセス、 https://www.frontiersin.org/journals/cellular-neuroscience/articles/10.3389/fncel.2022.916626/full
- Voltage-dependent block by Mg2+ of NMDA responses in spinal cord neurones, 11月 18, 2025にアクセス、 https://www.semanticscholar.org/paper/Voltage-dependent-block-by-Mg2%2B-of-NMDA-responses-Mayer-Westbrook/c874c4c1339eda7a27a004025dbdc38fc74b98df
- Slow Mg unblock and inherent voltage dependence of NMDA receptors by Richard J. Clarke Bachelor of Science, Allegheny College, 2 – D-Scholarship@Pitt, 11月 18, 2025にアクセス、 https://d-scholarship.pitt.edu/9104/1/ClarkeRC_ETD2006.pdf
- The Role of Voltage-Dependence of the NMDA Receptor in Cellular …, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3400125/
- Activity-dependent synaptic plasticity of NMDA receptors – PMC – PubMed Central – NIH, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2821550/
- “Calcium-dependent mechanisms and long-term potentiation: Role of NMDA ” by Kimberly Michele Huber – DigitalCommons@TMC – Texas Medical Center, 11月 18, 2025にアクセス、 https://digitalcommons.library.tmc.edu/dissertations/AAI9532505/
- Molecular Mechanisms Underlying LTP – Neuroscience – NCBI Bookshelf – NIH, 11月 18, 2025にアクセス、 https://www.ncbi.nlm.nih.gov/books/NBK11101/
- Long-Term Potentiation and Depression as Putative Mechanisms for Memory Formation, 11月 18, 2025にアクセス、 https://www.ncbi.nlm.nih.gov/books/NBK3912/
- NMDA receptor antagonist – Wikipedia, 11月 18, 2025にアクセス、 https://en.wikipedia.org/wiki/NMDA_receptor_antagonist
- The uncompetitive NMDA receptor antagonists ketamine and …, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3572289/
- NMDA Receptor Activation-Dependent Antidepressant-Relevant Behavioral and Synaptic Actions of Ketamine | Journal of Neuroscience, 11月 18, 2025にアクセス、 https://www.jneurosci.org/content/43/6/1038
- NMDA Receptor Antagonists for Treatment of Depression – MDPI, 11月 18, 2025にアクセス、 https://www.mdpi.com/1424-8247/6/4/480
- NMDA Receptor Activation-Dependent Antidepressant-Relevant Behavioral and Synaptic Actions of Ketamine – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC9908316/
- The Role of NMDA Receptors in Alzheimer’s Disease – Frontiers, 11月 18, 2025にアクセス、 https://www.frontiersin.org/journals/neuroscience/articles/10.3389/fnins.2019.00043/full
- A High-throughput Calcium-flux Assay to Study NMDA-receptors with Sensitivity to Glycine/D-serine and Glutamate – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC6126451/
- Role of glutamate and NMDA receptors in Alzheimer’s disease – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC5791143/
- REVIEW ARTICLE The role of excitotoxicity in neurodegeneration – Termedia, 11月 18, 2025にアクセス、 https://www.termedia.pl/REVIEW-ARTICLE-The-role-of-excitotoxicity-in-neurodegeneration,20,5375,1,1.html
- 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2948541/#:~:text=According%20to%20this%20new%20model,and%20extrasynaptic%20NMDARs%20are%20activated.
- Synaptic versus extrasynaptic NMDA receptor signalling …, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC2948541/
- NMDA receptor functions in health and disease: Old actor, new …, 11月 18, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/37236178/
- Synaptic and Extrasynaptic NMDA Receptors Differentially Modulate Neuronal Cyclooxygenase-2 Function, Lipid Peroxidation, and Neuroprotection | Journal of Neuroscience, 11月 18, 2025にアクセス、 https://www.jneurosci.org/content/31/39/13710
- NMDA receptor signaling: death or survival? – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3491906/
- Extrasynaptic NMDA Receptors Couple Preferentially to Excitotoxicity via Calpain-Mediated Cleavage of STEP | Journal of Neuroscience, 11月 18, 2025にアクセス、 https://www.jneurosci.org/content/29/29/9330
- Beyond NMDA Receptors: A Narrative Review of Ketamine’s Rapid and Multifaceted Mechanisms in Depression Treatment – MDPI, 11月 18, 2025にアクセス、 https://www.mdpi.com/1422-0067/25/24/13658
- Uncovering the Underlying Mechanisms of Ketamine as a Novel Antidepressant – Frontiers, 11月 18, 2025にアクセス、 https://www.frontiersin.org/journals/pharmacology/articles/10.3389/fphar.2021.740996/full
- Redefining Ketamine Pharmacology for Antidepressant Action: Synergistic NMDA and Opioid Receptor Interactions? | American Journal of Psychiatry, 11月 18, 2025にアクセス、 https://psychiatryonline.org/doi/10.1176/appi.ajp.20240378
- NMDA receptors in neurodegenerative diseases: mechanisms and emerging therapeutic strategies – PMC, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC12328396/
- NMDA receptor function, memory, and brain aging – PubMed, 11月 18, 2025にアクセス、 https://pubmed.ncbi.nlm.nih.gov/22034391/
- NMDA receptor function, memory, and brain aging – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC3181613/
- Ketamine: NMDA Receptors and Beyond – PMC – PubMed Central, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC5148235/
- NMDA Receptor Antagonists: Emerging Insights into Molecular Mechanisms and Clinical Applications in Neurological Disorders, 11月 18, 2025にアクセス、 https://pmc.ncbi.nlm.nih.gov/articles/PMC11124131/